
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
Гидролизом называется обменная реакция вещества с водой. В результате гидролиза солей сильных кислот и слабых оснований (NH4Cl) или слабых кислот и сильных оснований (СН3СООNa) образуются слабодиссоциированные кислоты или основания, что приводит к нарушению равенства концентраций ионов Н+ и ОН– в растворе, и раствор приобретает кислую или щелочную реакцию.
СН3СОО– + Н2О Û СН3СООН + ОН–,
Ка =  .
.
В разбавленных растворах  можно считать постоянной:
можно считать постоянной:
Ка ×  = Кг =
= Кг =  ,
,
где Кг - константа гидролиза.
Константа диссоциации уксусной кислоты
Кд,к = 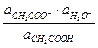 ;
;  =
=  / Кд,к.
/ Кд,к.
После подстановки (учитывая, что  = Кw)
= Кw)
Кг = Кw / Кд,к.
Аналогично для соли сильной кислоты и слабого основания (NH4Cl) можно получить
Кг = Кw / Кд,о.
Для соли слабой кислоты и слабого основания
CH3COO– + NH4+ + H2O Û CH3COOH + NH4OH,
Кг =  ;
;
 =
=  / Кд,к;
/ Кд,к;  =
=  / Кд,о;
/ Кд,о;
Кг =  / Кд,к × Кд,о = Кw / Кд,к × Кд,о.
/ Кд,к × Кд,о = Кw / Кд,к × Кд,о.
Таким образом, константы гидролиза солей можно рассчитать, зная константы диссоциации соответствующих слабых кислот и оснований.
Наряду с константой гидролиза реакции гидролиза характеризуются также степенью гидролиза. Степень гидролиза b - доля молекул соли, подвергшихся гидролизу, от общего числа молекул соли.
Для гидролиза CH3COONa
b =  , Кг =
, Кг = 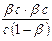 =
=  ,
,
где с - исходная концентрация CH3COONa.
В случае гидролиза соли слабого основания и сильной кислоты связь между Кг и b точно такая же. Зная Кг,можно рассчитать b, решая уравнение
с b2 + Кг b - Кг = 0.
При малых значениях b (b << 1 и 1-b» 1) Кг = с b2 и b = 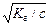 .
.
Если соль образована слабыми кислотой и основанием,
Кг =  =
=  .
.
При b<< 1 Кг = b2 и b = 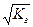 .
.
Анализ уравнений показывает, что степень гидролиза солей слабых кислот и сильных оснований и солей сильных кислот и слабых оснований уменьшается с ростом концентрации соли и увеличивается при разбавлении растворов; степень гидролиза солей слабого основания и слабой кислоты от концентрации раствора практически не зависит.
|
|
|
Зависимость Кг от температуры: Кw возрастает с ростом температуры очень значительно, Кд от Т почти не зависит, следовательно, Кг с повышением температуры увеличивается, соответственно возрастает и b.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 377; Нарушение авторских прав?; Мы поможем в написании вашей работы!