
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Й способ - по степени диссоциации всех продуктов диссоциации
|
|
|
|
Так как мы учитываем степень диссоциации продуктов, то число моль веществ в равновесной смеси оказывается выраженным через степень диссоциации следующим образом:
ni = f(a1, a2,…ai)
Поэтому уравнение баланса теплоты включает ni веществ в равновесной смеси, и уравнение энергии будет содержать температуру и степень диссоциации, т.е.:
Е(a1, a2,…ai, T)
Степень диссоциации в свою очередь есть функция от температуры.
Для определения температуры сгорания в дополнение к уравнению общего теплового эффекта (24) необходимо иметь уравнение, связывающие степень диссоциации и температуру. Число таких уравнений равно числу процессов диссоциации. Такими уравнениями являются уравнения для константы равновесия реакций диссоциации, где ni выражается через степень диссоциации:
K1 = f(a1, a2,….p)
K2 = f(a1, a2,….p)
………… (25)
Kn = f(a1, a2,….p)
Если давление (или объем) равны const, а КР = f(Т), то уравнения (25) выражают зависимость между степенью диссоциации и температурой.
f1 (a1, a2,….T) = 0
f2 (a1, a2,….T) = 0
………… (26)
fn (a1, a2,….T) = 0
Число таких уравнений равно числу степеней диссоциации.
Уравнение энергии Е(a1, a2,…ai, T) = 0 и уравнение (26) составляют систему уравнений - их число равно числу неизвестных величин.
Решение полученной системы уравнений позволяет определить все неизвестные величины a1, a2….an и температуру. Значение степени диссоциации определяет ni, т.е. состав продуктов сгорания. Кривая зависимости энтальпии от температуры проходит круче, чем для реакции полного сгорания без учета степени диссоциации.
Рассмотрим пример.
Определение равновесной температуры сгорания пропана.
С3Н8 + 5О2 + 5×3,76N2 = 3СО2 + 4Н2О + 5×3,76N2
5×3,76N2 - наличие N2 в воздухе (3,36 моль N2 на 1 моль О2)
|
|
|
При высоких температурах СО2 и Н2О частично диссоциируют:
СО + ½ О2 = СО2 ån = - ½
a1 ½ a1 1-a1
Н2 + ½ О2 = Н2О ån = - ½
a2 ½ a2 1-a2
ОН + ½ Н2 = Н2О ån = - ½
a3 ½ a3 1-a3
Реакцию неполного сгорания можно записать:
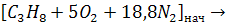 (27)
(27)
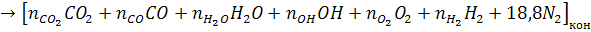
Реакции диссоциации хорошо изучены, известны зависимости константы от температуры:
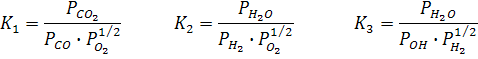
При сгорании 1 моль С3Н8 образуется 3 моль СО2 и 4 моль Н2О по (уравнению реакции) и учитывая соответствующие степени диссоциации можно выразить числа моль каждого из веществ в равновесной смеси:
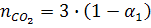
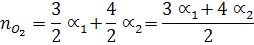
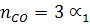
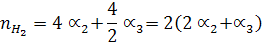
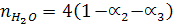
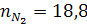
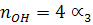
Общее число моль в равновесной смеси:
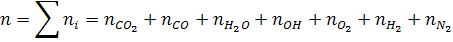
Отсюда n = 25,8 + 3/2a1 + 2a2 + 2a3
Учитывая, что a1, a2, a3 < 1, можно принять n = 25,8
Составим систему уравнений для определения температуры сгорания и степени диссоциации.
Используем выражение для константы равновесия, выраженное через моли:
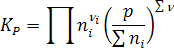
и напишем выражения для константы равновесия реакций диссоциации:
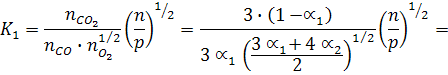
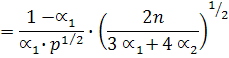
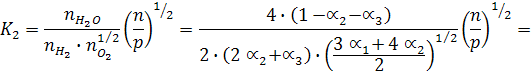
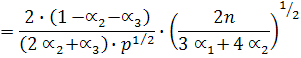
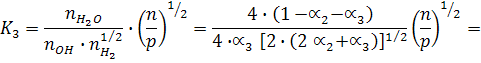
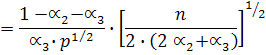
В общем виде: К1 = f(a1, a2, p)
K2 = f(a1, a2, a3, p)
K3 = f(a2, a3, p)
Так как р = const, а константа равновесия зависит от температуры, то
f1 (a1, a2, T) = 0
f2 (a1, a2, a3, T) = 0
f3 (a2, a3, T) = 0
Четвертым уравнением является уравнение общего теплового эффекта неполной реакции (24).
Так как Т1 = То, без учета фазовых превращений получим:
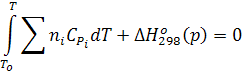 (28)
(28)
где DНо298(р) - стандартный тепловой эффект реакции, который может быть определен через DНобр всех веществ:

или
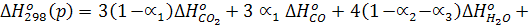
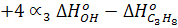
где 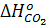 = - 394 000 кДж/моль
= - 394 000 кДж/моль
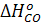 = - 110 200 кДж/моль
= - 110 200 кДж/моль
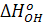 = - 25 100 кДж/моль
= - 25 100 кДж/моль
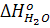 = - 242 000 кДж/моль
= - 242 000 кДж/моль
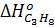 = - 103 700 кДж/моль
= - 103 700 кДж/моль
Так можно выразить 2-ой член уравнения (28).
1-ый член имеет следующий развернутый вид:
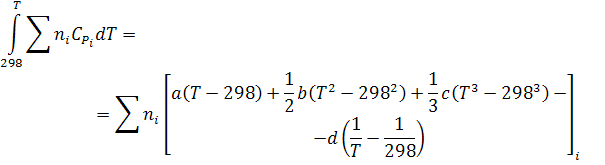 (29)
(29)
Подставляя значения ni для каждого i -го члена и объединяя со второй частью, получим развернутую форму уравнения (28). Обозначим его (29).
Таким образом, система уравнений для определения равновесной температуры и степеней диссоциации a1, a2, a3 адиабатной реакции горения пропана в воздухе при р = 1 бар имеет вид:
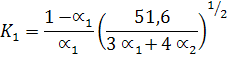
|
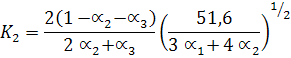
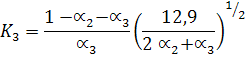
Уравнение (29)
Решение системы уравнений (30) дает величину равновесной температуры сгорания равной Тсгор = 2 275°К.
|
|
|
Данный результат получен для горения в теоретически необходимом количестве воздуха. Избыток воздуха приводит к уменьшению температуры сгорания.
При определении состава равновесной смеси и температуры сгорания с использованием закона сохранения массы элементов составляется и решается система уравнений:
- уравнение для общего теплового эффекта;
- уравнение для константы равновесия реакции;
- уравнения баланса атомов каждого элемента, число которых равно числу элементов.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!