
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительная двойственность
|
|
|
|
Окислители и восстановители
Восстановителем называется вещество, в состав которого входит элемент, повышающий степень окисления. Окислителем называется вещество, в состав которого входит элемент, понижающий степень окисления при протекании реакции.
С точки зрения электронной теории, окислением называют процесс отдачи электронов. Вещество, присоединяющее электроны и вызывающее таким образом окисление другого вещества, называется окислителем. Окислителями являются большинство неметаллов (галогены, кислород, сера и др.), многие кислородосодержащие кислоты (HNO3, H2SO4, HCIO4, HCIO3, HCIO2, HCIO, H2SeO4) и их соли (NaNO3, KCIO3, NaCIO2, NaCIO); соединения металлов в высших положительных степенях окисления (KMnO4, K2Cr2O7, K2FeO4).
Восстановлением, согласно электронной теории, называют процесс присоединения электронов. Вещество, отдающее электроны (и этим вызывающее восстановление другого вещества), называется восстановителем. Восстановителями являются металлы, соединения металлов в низших степенях окисления (FeSO4, SnCl2, CrCl3, MnSO4 и др.), некоторые неметаллы (водород, углерод), соединения неметаллов в отрицательных степенях окисления (NH3, H2S, HI, KI); соединения неметаллов в немаксимальных положительных степенях окисления (SO2, H2SO3, HNO2, NaNO2, H3PO3, H3PO2).
Многие вещества в зависимости от партнёра по реакции и условий её проведения могут быть как восстановителями, так и окислителями. Способность многих веществ быть как восстановителями, так и окислителями, называется окислительно-восстановительной двойственностью. Например, в ряду соединений, расположенных по возрастанию степени окисления азота
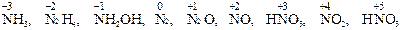 ,
,
аммиак обладает только восстановительными свойствами, так как в его составе азот находится в крайней отрицательной степени окисления, которая может только повышаться. Азотная кислота, наоборот, обладает только окислительными свойствами, так как азот в ней находится в крайней положительной степени окисления, которая может только понижаться. Остальные вещества, в которых азот находится в промежуточных степенях окисления, обладают окислительно-восстановительной двойственностью.
|
|
|
Таким образом, окислительно-восстановительной двойственностью обладают вещества, в состав которых входят элементы в промежуточных степенях окисления.
Пример 7. Среди данных соединений укажите окислители, восстановители и вещества с окислительно-восстановительной двойственностью: 1) FeCl3, K2FeO4, Fe; 2) K2S, H2SO4, Na2SO3
Решение. В перечне 1 степень окисления железа в соединениях равна +3 (FeCl3), +6 (K2FeO4) и 0 (Fe), следовательно окислителями являются феррат калия K2FeO4, восстановителем – железо (Fe), а хлорид железа (III) FeCl3 обладает окислительно-восстановительной двойственностью.
В перечне 2 окислителем является серная кислота (степень окисления серы +6 – максимальная), восстановителем – H2S (степень окисления серы –2 – минимальная), а двойственными свойствами обладает сульфит натрия Na2SO3 (степень окисления серы +4 – промежуточная).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 6241; Нарушение авторских прав?; Мы поможем в написании вашей работы!