
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения марганца в ОВР
|
|
|
|
Перманганат-ион выступает окислителем в любой среде, от рН среды зависит продукт восстановления перманганата-иона. Кислую среду создают серная, азотная, соляная и другие сильные кислоты, раствор сернистого газа. Азотная кислота помимо создания кислой среды будет проявлять окислительные свойства, а соляная (и другие галогеноводородные кислоты, кроме HF) – восстановительные свойства. Щелочная среда создается растворами щелочей и аммиака, сульфидов щелочных металлов. Тот или иной продукт восстановления объясняется его устойчивостью в данной среде. В некоторых заданиях С1 в качестве продукта восстановления KMnO4 в щелочной среде указывается оксид марганца (IV). Это объясняется тем, что манганат (K2MnO4) в принципе неустойчивое вещество и в растворе самопроизвольно диспропорционирует на оксид марганца(IV) и перманганат.
Схема 1. Поведение перманганат-иона в ОВР
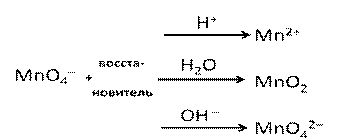
| KMnO4 + восстановители → | ||
| в кислой среде Mn+2 MnO4- + 5e- + H+→ Mn2+ | в нейтральной среде Mn+4 MnO4- + 3e- + H2O→ MnO2 | в щелочной среде Mn+6 MnO4- + 3e- + OH- → MnO4 2- |
| (соль той кислоты, которая участвует в реакции) MnSO4, MnCl2 | MnO2↓ | Манганат (K2MnO4 или Na2MnO4) |
| 5K2SO3 + 2KMnO4 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O | 2КМnО4+ 3Na2SО3 + Н2О → 3Na2SО4 + 2МnО2 + 2КОН | K2SO3 + 2KMnO4 + 2KOH → K2SO4 +2K2MnO4 + H2O |
Приведем примеры, следуя выше указанной схеме:
KMnO4 + К2SO3 + H2SO4 ®
Окислитель восстановитель создает кислую среду,
Следовательно перманганат превратится в сульфат марганца (II), сульфит окислится до сульфата, ионы калия свяжутся сульфат-ионами, ионы водорода превратятся в воду.
2KMnO4 + 5К2SO3 + 3H2SO4= 6К2SO4+ 2MnSO4+ 3H2O
KMnO4 + К2SO3+ H2O ®
Окислитель восстановитель среда близка к нейтральной (слабо щелочная из-за гидролиза сульфита), следовательно перманганат превратится в оксид марганца (IV), сульфит окислится до сульфата, ионы калия свяжутся с гидроксид-ионами.
|
|
|
2KMnO4 + 3К2SO3 + H2O = 3К2SO4+ 2MnO2+2KOH
KMnO4 + К2SO3 + KOH ®
Окислитель становитель создает щелочную среду,
Следовательно перманганат превратится в манганат калия, сульфит окислится до сульфата, побочный продукт - вода:
2KMnO4 +К2SO3 + 2KOH = К2SO4+ 2 K2MnO4+ H2O
2KMnO4 + 5SO2 + 2H2O = К2SO4+ 2MnSO4+ 2H2 SO4
Создает кислую среду
Другие соединения марганца:
| Cоли марганца (II), оксид марганца (IV) и манганаты | ||
| кислая среда | нейтральная среда | щелочная среда |
| KMnO4 — перманганат HMnO4 — марганцевая кислота | оксид марганца (IV) | K2MnO4 — манганат |
| 2Mn(NO3)2 + 5PbO2 + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2H2O 2MnSO4+ 5NaBiO3 +16HNO3 → 2HMnO4 + 2Na2SO4 +7H2O + NaNO3+5Bi (NO3)3 2Mn(NO3)2 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O | MnCl2 + O3 +H2O → MnO2 + O2 + 2HCl | MnO2 +KNO3 + 2KOH→ K2MnO4 + H2O + KNO2 Mn(OH)2 + 2Cl2 + 6KOH → K2MnO4 + 4H2O + 4KCl |
Манганат-ион также может выступать окислителем (в нейтральной и кислой среде):
Схема 2. Поведение манганат-иона в ОВР
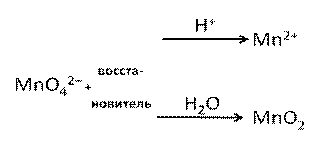
Оксид марганца (IV) выступает окислителем в кислой среде с образованием солей манганца (II):
Cоли марганца (II), оксид марганца (IV) и манганаты могут выступать восстановителями, при этом продукт их окисления также зависит от среды: в нейтральной среде получится оксид марганца (IV), в щелочной – манганат, в кислой – перманганат.
Примеры:
MnCl2 + O3 + H2O = MnO2 + O2+ 2HCl
восстановитель окислитель нейтральная среда продукт окисления
Mn(OH)2 + 2Cl2 + 6KOH = K2MnO4 + 4H2O + 4KCl
восстановитель окислитель щелочная среда продукт окисления
MnO2 + KNO3 + 2KOH = K2MnO4 + H2O + K NO2
восстановитель окислитель щелочная среда продукт окисления
2MnSO4+ 5NaBiO3 +16HNO3 = 2 HMnO4 + 2Na2SO4 + 7H2O + NaNO3+5Bi (NO3)3
Восст-ель окис-ль кислая среда продукт окисления
СОЕДИНЕНИЯ ХРОМА В ОВР
Продукты восстановления хроматов и дихроматов также зависят от среды. Хроматы могут существовать в нейтральной и щелочной среде, дихроматы – в кислой и нейтральной. В кислой среде, как правило, продуктом восстановления является соль хрома +3, в нейтральной – гидроксид хрома (III), в щелочной – комплексная соль, гексагидроксохромат.
|
|
|
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 7494; Нарушение авторских прав?; Мы поможем в написании вашей работы!