
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Плоскость сравнения 8 страница
По режиму функционирования источники разделяются на:
а) постоянно действующие;
б) сезонно действующие;
в) ритмически действующие.
По температурной характеристике источники могут подразделяться (по классификации К.Ф. Богородицкого) на следующие группы и подгруппы (табл. 9).
. Таблица 9 Классификация природных вод по температуре
| Группа вод | Подгруппа вод | Температура воды, °С |
| Холодные | Переохлажденные Очень холодные Холодные | <0 0-10 10-20 |
| Низкотермальные | Теплые Горячие | 20-37 37-50 |
| Высокотермальные | Очень горячие Перегретые | 50-100 >100 |
Источники подземных вод в ряде случае связаны с нефтегазовыми месторождениями, так как принадлежат к единой водонапорной системе. В результате разработки залежей углеводородов (УВ), когда из пласта отбирается большое количество нефти и воды и образуется обширная воронка депрессии, происходит падение дебитов источников, • а нередко и их исчезновение. Подобное явление отмечено Г.М. Сухаревым (1956) в Терско-Сунженской нефтегазонос-ной области, где в результате эксплуатации нефтяных месторождений иссякли Мамакай-Юртовские, Горячеводские и другие источники.
8.2. Основы гидрогеохимии
Гидрогеохимия - раздел гидрогеологии, в котором изучаются:
ионно-солевой и газовый составы природных вод, органические вещества и коллоиды.
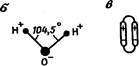
Многие химические свойства и особенности воды обусловлены строением ее молекулы. По современным представлениям в молекуле воды атомы кислорода и водорода как бы приурочены к вершинам равнобедренного треугольника. При этом атом кислорода связан с двумя значительно меньшими атомами водорода. Это приводит к ее поляризации. Из десяти имеющихся электронов два расположены непосредственно у кислорода, восемь образуют четыре вытянутые электронные орбитали. Оси двух из этих орбита-лей направлены вдоль связи 0-Н, а двух других лежат приблизительно в плоскости, идущей через ядро кислорода перпендикулярно к плоскости Н-О-Н. Электроны движутся в пределах орби-талей попарно. С протонами водорода, находящимися внутри двух орбиталей, связаны два полюса положительных электрических за-
рядов воды. Электроны, располагающиеся на двух других орбитах, представляющих неподеленные пары, создают два полюса отрицательных зарядов той же молекулы. Существование неподеленных электронных пар приводит к образованию двух водородных связей. Две другие водородные связи возникают за счет двух водородных атомов. Поэтому каждая молекула воды в состоянии образовать четыре водородные связи (рис. 40).
Суть водородной связи сводится к тому, что ион водорода, связанный с каким-то ионом другого элемента, способен электростатически притягивать к себе ион того же элемента из другой молекулы. В силу этого молекулу воды можно уподобить тетраэдру, два угла которого заряжены положительно, а два отрицательно.
Таким образом, молекула воды представляет собой электрический диполь. Угол связи в молекуле воды, образованный двумя атомами водорода (Н-О-Н), равен 104,5°.
Разноименные полюса диполей притягиваются друг к другу, чем обусловливается образование более сложных агрегатов, таких как дигидроль (НзО);?, тригидроль (Н20)з и т.д. С ростом температуры и переходом воды в парообразное состояние сложные агрегаты распадаются на более простые, а те в свою очередь на одиночные молекулы. Жидкая вода состоит из более или менее упорядоченных молекул, приближающихся по своему строению к кристаллической решетке. Для льда наиболее устойчивой структурой является тетраэдры, построенные из гидролей. Эти тетраэдры объединены в гексагональную решетку (рис.41), рыхлую и ажурную, поэтому плотность льда меньше плотности жидкой воды.
В силу особенностей строения молекул воды и наличия водородных связей вода обладает целым рядом аномальных свойств:
высокой диэлектрической постоянной (87,74 при 0°С), расширением при замерзании, сильными растворяющими свойствами, высокой скрытой теплотой испарения и плавления и т.д. На структуру воды влияет также магнитное поле, меняя ее свойства. "Омагниченная" вода используется для снижения накипи в котлах, для закачивания в пласты при разработке нефтяных месторождений. При ее закачке в пласт снижается солеобразование в трубах, улучшаются нефтевымывающие свойства вод и т.д. После-прекращения действия магнитного поля некоторое время эти свойства сохраняются. Это объясняется особенностями внутренней структуры воды.
Молекулы воды состоят из водорода, представленного тремя изотопами (протий + 1]-!; дейтерий sh, или Д; тритий sh, или Т), и кислорода, имеющего семь изотопов (^О-^О). Преобладают в
- 188 -
|
Рис.40. Модель молекулы воды:
а - схема тетраэдрического характера водородной связи в воде; б - угол связи в молекуле воды; в - образование диполями воды ассоциированных молекул (дигидроля, тригидроля)
Рис.41. Гексагональная структура льда
воде ^Н и ЧбО. Дейтерий и тритий содержатся в обычной воде в незначительных количествах. Подавляющее количество изотопов кислорода представлено изотопами ^О, меньше изотопов ^О и ничтожно мало изотопов ^О. Кроме тяжелой воды ДзО известна и сверхтяжелая вода Т^О.
- 189 -
Вода - хороший растворитель различных солей, газов и коллоидов. В настоящее время в подземных водах обнаружено более 86 элементов периодической системы. Такое разнообразие химического состава подземных вод обусловлено их геологической историей и постоянным взаимодействием с веществом земли. В физико-химическом отношении природные воды - это растворы солей, газов и коллоидов. Соли как правило, являясь электролитами, при растворении в воде распадаются на ионы: отрицательно заряженные - анионы, положительно заряженные - катионы. Растворы солей - электролиты проводят электрический ток. Вещества - неэлектролиты при растворении в воде распадаются на нейтральные молекулы, давая истинные растворы, или на агрегаты молекул, образуя коллоидные растворы. В природных водах содержание коллоидов невелико по сравнению с содержанием растворенного ионно-солевого комплекса.
В наибольших количествах в подземных водах встречаются шесть главных ионов: анионы Cl-, S042', НСОз" и катионы Na"1",
Са2"*", Mg2"1". Эти вещества, определяющие химический тип воды, относятся к макрокомпонентам, или макроэлементам.
В значительно меньших концентрациях распространены СОз2",
S2-, К."1", Fe2"1", и Fe3"1". Элементы, встреченные в незначительных количествах, называются микроэлементами, или микрокомпонентами. Из их числа наибольший практический интерес представляют ионы и I-, Br, Li4", Sr2"*" и др.
Суммарное содержание в воде растворенных ионов, солей и коллоидов характеризует степень минерализации воды. Минерализация обычно выражается в граммах на 1 кг раствора или на 1 л раствора.
По ГОСТу воды с минерализацией до 1 г/кг относятся к пресным, от 1 до 25 г/кг к солоноватым, от 25 до 50 г/кг к соленым и при минерализации более 50 г/кг к рассолам. Минерализация природных вод колеблется в широких пределах - от долей грамма на 1 кг до сотен граммов на 1 кг.
Растворенные газы находятся во всех подземных водах. Наиболее распространены такие газы, как азот N2, диоксид углерода (углекислый газ) СОз, метан СН4. Кроме этих основных газов в подземных водах растворены такие газы, как кислород 0^, сероводород H^S, аргон Аг, гелий Не, этан С^Н^, пропан СзН@, бутан С4Ню. Этан, пропан, бутан, т.е. углеводородные газы, обычно связаны с нефтегазоносными отложениями. Газы находятся в водах в виде молекулярных растворов. Такие газы,
- 190
как диоксид углерода СОз и сероводород HzS, образуют с ионно-солевыми компонентами равновесные системы.
Объем газа (измеренный в нормальных условиях - при давлении 760 мм рт. ст. и температуре 20°С), растворенного в единицах объема воды, называют газонасыщенностью воды. Она представляет собой сумму объемов всех растворенных газов и выражается в смЗ/л, смЗ/см3 или м3/м3.
Давлением насыщения (упругостью) растворенного газа называется то давление, при котором весь газ находится в растворенном состоянии. Упругость растворенного газа равна объему растворенного газа, деленному на коэффициент его растворимости. Эта зависимость, отвечающая закону Генри, имеет применение лишь при упругости менее 5 МПа, так как растворимость газов с ростом давления увеличивается не прямо пропорционально. При сложном составе растворенных газов и высоких давлениях насыщения существует более сложная зависимость.
Коэффициент растворимости газа зависит от минерализации воды в соответствии с уравнением Сеченова:
снижается по мере увеличения минерализации. При росте температур примерно до 100°С растворимость газов уменьшается, при более высоких температурах увеличивается.
Схем классификаций растворенных в подземных водах газов много. Они предложены разными исследователями. (И.С. Старобинцем, В.И. Ермаковым, В.И. Старосельским и др.). Л.М. Зорькин (1973) в классификации растворенных в пластовых водах газов по их составу выделяет четыре класса:
1) углеводородный (метановый), в случае, если С„Н„, >50 %;
2) азотный, когда азота > 50 %;
3) углекислый, когда СОз + Из8 = 50 %!
4) углекисло-азотно-метановый.
В каждом классе выделяется тип газа по содержанию компонентов.
В природных водах литосферы встречаются разнообразные органические вещества. Они находятся в растворе в ионной, молекулярной, коллоидной формах, а также в виде микроэмульсии. Из органических соединений в водах земной коры встречаются: жирные кислоты, нафтеновые кислоты, фенолы, бензол, толуол, азотосодержащие и фосфорсодержащие вещества, аминокислоты и некоторые другие. Для нефтегазовой гидрогеологии наибольший интерес представляют углеводороды (УВ) и жирные кислоты. Из жидких УВ наиболее распространены ароматические - бензол и его гомологи (толуол, ксилолы),
- 191 -
имеющие поисковое значение. Общее содержание органических веществ может быть охарактеризовано величиной Сорг. По данным В.М. Швеца (1982), среднее
содержание Сдрг (мг/л): в грунтовых водах - 25, в пластовых водах
продуктивных горизонтов нефтяных месторождений - 110, в приконтурных водах нефтяных месторождений - 370, в приконтурных водах газоконденсатных месторождений - 800.
Из химических свойств воды к наиболее значимым относятся щелочно-кислотные свойства и жесткость.
Щелочно-кислотные свойства воды определяются содержанием в воде водородных (Н*) и гидроксильных (ОН-) ионов. Кислотные свойства водного раствора определяются действием водородных ионов, а щелочные - гидроксильных. Поэтому количественно степень кислотности водной среды может быть охарактеризована концентрацией или активностью иона Н\ а степень его щелочности - концентрацией или активностью ионов ОН". Общие кислотно-щелочные состояния водного раствора условно характеризуются концентрацией или активностью водородных ионов, выраженной величиной рН, которая равна -lg(H"1"). При рН = 7 реакция нейтральная. В кислотной среде рН < 7, в щелочной рН > 7. рН подземных вод изменяется в пределах от 6 до 8,5.
Жесткость воды зависит от содержания растворенных солей кальция и магния. Выделяют общую, устранимую и постоянную жесткость. Общая жесткость определяется суммарным содержанием хлоридов, сульфатов и гидрокарбонатов Са2* и Mg2"*". Устранимая жесткость соответствует содержанию Са(НСОз)2 и Mg(HC03)2, которые при кипячении выделяют осадок (СаСОз и MgC03). Постоянная жесткость представляет собой содержание хлоридов и сульфатов кальция и магния.
В настоящее время жесткость определяют и выражают по содержанию в воде кальция и магния в ммоль/г или мг-экв/г.
Из физических свойств природных вод основными являются плотность, вязкость, сжимаемость, электропроводность, радиоактивность, температура.
Плотность - отношение массы вещества к его объему. Плотность химически чистой воды при температуре 4°С равна 0,999973 г/см3. Но обычно ее принимают равной 1 г/см3.
Под относительной плотностью(р420) понимается отношение плотности вещества при температуре 20°С к плотности
-192
дистиллированной воды при температуре 4°С. Плотность природных вод возрастает с увеличением степени минерализации. Обычно плотность природных вод колеблется в пределах 1-1,4 г/см3. Плотность воды зависит от температуры. Эта зависимость определяется коэффициентом объемного теплового расширения а, показывающим, какую часть первоначального объема тела при 0°С составляет изменение объема при изменении температуры на 1°С.
При увеличении температуры от 0 до 4°С вода уменьшается в объеме, а при дальнейшем ее росте неравномерно увеличивается. Коэффициент объемного расширения воды составляет, 1/град: в интервале 4-10 °С - 6,5-Ю-5, в интервале 10-20°С - 15-Ю-5, в интервале 65-70°С - 58-10-5. Кроме того, с повышением давления вода несколько сжимается.
Вязкость - свойство природных вод, обусловливающее при движении возникновение силы трения. Вязкость воды зависит от температуры и минерализации: она возрастает с ростом минерализации и уменьшается с повышением температуры..
Сжимаемость вод определяется как изменение ее объема под действием давления. Коэффициент сжимаемости /?
показывает, насколько уменьшается объем воды при увеличении давления на одну единицу. Коэффициент сжимаемости зависит от температуры, содержания водорастворенных газов и химического состава воды.
Сжимаемость воды с растворенным газом приближенно вычисляется по формуле:
/^-/? (1+0,05(7),
где G - газонасыщенность.
В недрах под действием давления объем жидкостей уменьшается.
Для оценки суммарного воздействия этих факторов используется объемный коэффициент пластовой воды b -отношение удельного объема жидкости Рдл в пластовых условиях к удельному объему V^ той же жидкости при давлении 100 кПа и температуре 20°С: b = V^IV^. Природные воды характеризуются
объемными коэффициентами порядка 1-1,2.
Электропроводность подземных вод имеет важное значения для геофизических исследований. Электропроводность и электрическое сопротивление зависят от химического состава подземных вод и минерализации. О величине электропроводности
| 13 Каналин |
| - 193 |
можно судить по удельному электрическому сопротивлению, т.е. сопротивлению в омах такого проводника электрического тока, длина в сечение которого равны единице. При геофизических исследованиях за единицу удельного сопротивления берут 1 Ом-м. Подземные воды характеризуются величинами удельных сопротивлений от 0,02 до 1 Ом-м. С увеличением температуры и минерализации удельное сопротивление уменьшается.
Радиоактивность природных вод определяется наличием в них радиоактивных элементов - радия, радона, урана. К радиоактивным относятся воды, содержащие радия более 1- Ю-14 г/л, урана более 3-10-5 г/л, радона более 1,5 10-20 бк. В водах нефтеносных пластов нередки случаи повышенной радиоактивности.
Для изучения ионно-солевого состава подземных вод используются различные виды химических анализов.
Общий анализ позволяет судить о химизме воды. Он включает определение шести основных ионов: Cl-, S042-, НСОз', Ca2"1",
Mg2-*-, Na"1". Натрий обычно определяется по разности в содержании трех анионов и двух катионов: кальция и магния. Анализ, включающий определение этих шести ионов, плотности и рН воды, называют стандартным анализом.
В нефтегазовой гидрогеологии к стандартному комплексу добавляется определение йода, брома, аммония, бария, стронция, железа, алюминия, органических кислот и их солей и некоторых других.
Из специальных анализов подземных вод следует отметить:
санитарный, бактериологический, бальнеологический, различные технические анализы. Санитарный анализ производится для оценки пригодности воды для питьевых целей, технические анализы - для определения пригодности воды, например, для закачки ее в пласт при заводнении, для использования воды в различных парокотельных установках, бактериологический - для установления видов бактерий и их количества. Наиболее полным является бальнеологический анализ, предназначенный для оценки лечебных свойств воды. К комплексу стандартного анализа в нем добавляется изучение газовых и радиоактивных компонентов, микрокомпонентов и т.д.
Анализы вод производятся как в полевых, так и в стационарных условиях в гидрохимических лабораториях. Результаты анализа вод принято изображать в трех формах: масс-ионной, ионно-эквивалентной и процент-эквивалентной.
Масс-ионная форма - выражение состава воды в единицах массы отдельных ионов. Масс-ионную форму пересчитывают в
ионно-эквивалентную путем деления величин содержания ионов, выраженных в граммах или миллиграммах, на величину эквивалента иона. Эквивалентом иона называется частное от деления ионной массы на валентность.
Ниже приведены величины эквивалентов основных ионов:
| Ионы сг so^~ НСОз COJ" |
| Na' |
| Ca |
| 2+ |
| Mg- |
| 2+ |
| Эквивалент 35,476 (35,5) 48,03 (48) 61,00 30,00 22,997 (23) 20,035 (20) 12,16(12) |
Наличие перед химическим символом буквы г означает, что содержание данного элемента выражено в ионно-эквивалентной форме. Если анионы и катионы даны в ионно-эквивалентной форме, то по принципу электронейтральности 2/к = Z^a Используя это равенство и имея данные о содержании в воде пяти ионов, можно найти содержание шестого иона. Так определяется содержание натрия:
г Na = 2>а- (г Ca24' +rMg2+)
Процент-эквивалентная форма показывает относительную долю каждого иона в общей сумме растворенных ионов. Общая сумма всех ионов, взятых в эквивалентной форме, приравнивается к 100 %, а сумма катионов, равная сумме анионов, составляет 50 %.
Процент-эквивалентная форма позволяет применять различные способы изображения химического состава воды. К числу таких способов принадлежит формула, предложенная гидрогеологом М.Г. Курловым. Она представляет собой псевдодробь, в числителе которой указывают содержание в процент-эквивалентах анионов, а в знаменателе - катионов. Ионы записывают по убывающим величинам. Ионы, содержащиеся в количестве менее 1 %,не указывают. Перед дробью перечисляют основные компоненты состава растворенных газов и величину
13*- 195 -
|
|
Рис.42. Способы изображения результатов химического и газового состава вод:
а - формула Курлова; б - график-круг Толстихина; в - график-круг газового состава вод
минерализации в граммах на литр, за дробью проставляют температуру, содержание микрокомпонентов в мг/л и т.д. (рис. 42, а).
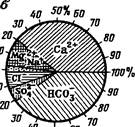
Из графиков, характеризующих ионно-солевой и газовый составы вод, наибольшим распространением пользуются круговые диаграммы. Примером может служить график - круг Толстихина (рис. 42, б). Минерализация воды обычно соответствует радиусу круга, взятому в определенном масштабе.
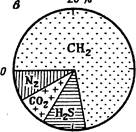
Принимая эквивалентное содержание суммы анионов и катионов соответственно за 100 %, можно найти процентное содержание каждого иона. Такие графики удобны для нанесения анализов вод на карты и профильные разрезы. При помощи графиков-кругов можно изображать и газовый состав вод (рис. 42, в). Радиус круга в определенном масштабе будет изображать общую газонасыщенность, а секторы - процентное содержание каждого газа.
Большое разнообразие химического состава природных вод вызвало необходимость систематизации многочисленных данных и создания химической классификации. За основу классификации исследователи принимали различные признаки и показатели состава вод, поэтому универсальной классификации пока не существует. Среди наиболее известных - классификации Ч. Пальмера, Ч. Кларка, В.И. Вернадского, С.А. Щукарева, О.А. Алекина, В.А. Сулина, Н.И. Толстихина, Л.С. Балашова, М.Г. Валяшко и др.
В нефтегазовой гидрогеологии широко распространена классификация В.А. Сулина. В ней все природные воды подразделяются на четыре типа по характерным соотношениям между главнейшими ионами и затем на группы и подгруппы по признаку преобладания различных анионов и катионов. Характерные отношения между ионами, положенные в основу классификации, выражаются тремя коэффициентами, названные генетическими:
| rNa?С1 |
| rNa - rCl |
| rCl - rNa |
| С помощью этих коэффициентов генетических типа вод (Табл. В.А. Сулину соответствует определенная вания вод. |
| rMg выделяются четыре 10), которым по обстановка формиро- |
Таб-лица 10
Классификация вод по В.А. Сулину
| Тип вод | rN^ | yNa4 - гС\~ | rCl' - г^ |
| fC\~ | rS042" | rMg~ | |
| Гидрокарбонатно-натриевый Сульфатно-натриевый Хлоридно-магниевый Хлоридно-кальциевый | >1 >1 <1 <1 | >1 <1 | <1 >1 |
Каждый тип делится на три группы по преобладающему аниону (хлоридную, сульфатную или гидрокарбонатную). По преобладающему катиону группы делятся на подгруппы: натриевую, магниевую и кальциевую; однако подгруппа выделяется только в том случае, если преобладающий катион дает основную солевую массу с преобладающим же анионом.
Типы вод называют генетическими, потому что они приблизительно отвечают определенным обстановкам существования природных вод. Так, сульфатно-натриевый и гидрокарбонатно-натриевый типы отвечают континентальной обстановке формирования вод, хлоридно-магниевый - морской, хлоридно-кальциеьый тип - глубинной.
Такое соответствие справедливо лишь в самых общих чертах.
8.3. Основы гидрогеомеханики
Подземные воды - наиболее.динамичная часть литосферы. Все процессы, происходящие в земной коре, так или иначе влияют на перемещение подземных вод. В свою очередь, движение вод в породах влияет на геологические и физико-химические процессы, происходящие в недрах, поэтому горные породы с заключенными в них водами представляют собой единую систему, элементы которой тесно связаны между собой. Различные виды движения подземных вод можно выделять по нескольким признакам. Так, движение капельножидкой воды в породах происходит главным образом в форме фильтрации, представляющей собой механический процесс течения свободной жидкости в пористо-трещинной среде. Рассмотрение такого процесса является предметом изучения механики подземных вод, т.е. гидрогеомеханики. С учетом того, что все подземные воды представляют собой растворы, разные по химическому составу и плотности, движение жидкости может осуществляться и за счет естественной конвекции, обусловленной наличием градиента их плотности внутри жидкости и за счет молекулярной диффузии, происходящей в результате влияния градиента концентрации веществ внутри раствора.
Вопросы, связанные с влиянием физико-химических факторов на движение жидкостей, рассматриваются физико-химической гидродинамикой.
С позиции гидрогеомеханики различают турбулентное и ламинарное движение. Турбулентное движение характерно в основном для карстовых вод. Ему свойственны беспорядочность движения струй, пульсация, активное гидравлическое перемешивание, возникающее при больших скоростях потоков. Такой тип движения присущ подземным потокам в карстовых полостях карбонатных пород в горных массивах, например, таких, как Альпы, Пиренеи, Кордильеры и др.
Основной вид движения свободных подземных вод -ламинарная фильтрация, подчиняющаяся закону Дарси. А. Дарси - французский ученый, перед которым в пятидесятых годах прошлого столетия поставили задачу обеспечения города Дижона подземной водой. Так как вода быстрой реки Роны сильно взмучена и для ее очистки требовались большие затраты в связи с сооружением фильтров и отстойников, возникла мысль воспользоваться для водоснабжения города подрусловыми водами из аллювиальных отложений. Но, чтобы
- 198 -
обеспечить строительство водопровода, необходимо было подсчитать количество воды, протекающее в единицу времени через сечение подрусловой части реки, т.е. расход воды. Для этого А. Дарси проводил опыты на трубках, набитых песком, через которые пропускал воду при различных перепадах давления. На основании проведенных экспериментов им была выведена зависимость, получившая название закона Дарси:
где Q - расход потока; А-д, - коэффициент фильтрации; F - площадь поперечного сечения фильтрующей среды; А Н - перепад напоров; A L - длина участка фильтрационного потока.
Поток воды в опытах А. Дарси проходил в довольно однородной среде, т.е. в трубах, набитых • хорошо отсортированным песком. В реальных условиях трещинно-поро-вое пространство горных пород характеризуется сложным строением. Его геометрия меняется в водоносных пластах и по площади, и по разрезу, поэтому изучение фильтрационного потока представляет большие трудности. В этой связи под фильтрационным потоком принято считать условный поток жидкости через пористую среду (породу).
Хотя реальный поток идет только по открытым (сообщающимся) порам и трещинам, условно допускается, что фильтрационный поток идет через всю породу. К элементам фильтрационного потока относятся пьезометрический напор, напорный градиент, линии напоров, линии тока, скорость фильтрации и расход потока.
Пьезометрический напор подземных вод:
Н= +Z,
Р8
где р - гидростатическое давление в данной точке потока;
р- плотность воды; Z - высота данной точки потока над выбранной плоскостью сравнения; g - ускорение свободного падения.
Отношение у, или hp, называется пьезометрической
высотой. Это высота, на которую должна подняться вода над данной точкой потока под влиянием гидростатического давления р
- 199
| 7, Рис.43. Графическое изображение пьезометрического напора |
в данной точке (рис.43). В случае грунтового потока /;„ равна
глубине погружения данной точки от зеркала грунтовых вод.
Почти все пласты в земных недрах залегают с определенным наклоном. Поэтому, чтобы производить расчеты по формуле Дарси, необходимо напоры вод, отражающие гидростатические давления в пласте, привести к условно выбранной плоскости сравнения.
Таким образом, напор будет равен сумме пьезометрической (hp) и геометрической (Z) высот над условно выбранной
плоскостью сравнения.
Гидравлический уклон (напорный градиент) - величина падения напора на единицу длины по направлению фильтрации:
;•= АН/ • /AL •
Подставляя это обозначение, формулу Дарси можно записать таким образом:
Q=k^H.
Напоры в пределах потока распределены в соответствии с положением пьезометрической поверхности. Поверхности, обладающие во всех точках равными напорами, называются поверхностями равных напоров. Следы сечения этих поверхностей горизонтальными плоскостями - линии равных напоров. Проекция этих последних на горизонтальную плоскость -гидроизопьезы(для грунтовых вод - гидроизогипсы). Линии токов направлены по отношению к гидроизопьезам под прямым углом.
-200
Скорость, фильтрации можно получить, разделив величину расхода потока на площадь поперечного сечения фильтрующей среды:
г=^фг.
Следовательно, скорость фильтрации равна произведению коэффициента фильтрации на гидравлический уклон. Как видно из формулы, закон Дарси указывает на линейную зависимость расхода фильтрационного потока от гидравлического градиента. Параметром этой линейной зависимости является коэффициент фильтрации (&:ф), который зависит как от свойств горной породы,
|
|
Дата добавления: 2014-12-27; Просмотров: 519; Нарушение авторских прав?; Мы поможем в написании вашей работы!