
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Одноосновные непредельные карбоновые кислоты
|
|
|
|
Одноосновные непредельные кислоты- производные ненасыщенных углеводородов, у которых один атом водорода замещен карбоксильной группой.
Номенклатура, изомерия.
В группе непредельных кислот наиболее часто используют эмпирические названия: СН2=СН-СООН - акриловая (пропеновая) кислота, СН2=С(СН3)-СООН - метакриловая (2-метилпропеновая) кислота. Изомерия в группе непредельных одноосновных кислот связана с:
а) изомерией углеродного скелета;
б) положением двойной связи;
в) цис-транс-изомерией.
Способы получения.
1. Дегидрогалогенирование галогенозамещенных кислот:
СН3-СН2-СНСl-СООН ---KOH(конц)---> СН3-СН=СН-СООН
2. Дегидратация оксикислот:
НО-СН2-СН2-СООН -> СН2=СН-СООН
Физические свойства.
Низшие непредельные кислоты - жидкости, растворимые в воде, с сильным острым запахом; высшие - твердые, не растворимые в воде вещества, без запаха.
Химические свойства.
Химические свойства непредельных карбоновых кислот обусловлены как свойствами карбоксильной группы, так и свойствами двойной связи. Специфическими свойствами обладают кислоты с близко расположенной от карбоксильной группы двойной связью - альфа, бета-непредельные кислоты. У этих кислот присоединение галогеноводородов и гидратация идут против правила Марковникова:
СН2=СН-СООН + НВr -> СН2Вr-СН2-СООН
При осторожном окислении образуются диоксикислоты:
СН2=СН-СООН + [О] + Н20 -> НО-СН2-СН(ОН)-СООН
При энергичном окислении происходит разрыв двойной связи и образуется смесь разных продуктов, по которым можно установить положение двойной связи. Олеиновая кислота С17Н33СООН - одна из важнейших высших непредельных кислот. Это - бесцветная жидкость, затвердевает на холоде. Ее структурная формула: СН3-(СН2)7-СН=СН-(СН2)7-СООН.
|
|
|
Двухосновные карбоновые кислоты (или дикарбоновые кислоты) — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал.
Дикарбоновые кислоты проявляют те же химические свойства, что и монокарбоновые — эти свойства обусловлены наличием карбоксильной группы:
· диссоциация в водных растворах
· первая стадия (Ka1):
НOOC—Х—СООН → НOOC—Х—СОО− + Н+
Дикарбоновые кислоты — более сильные кислоты по первой стадии диссоциации, чем соответствующие монокарбоновые: во-первых, из-за статистического фактора (две карбоксильных группы в молекуле), во-вторых, из-за взаимного влияния этих групп (если они находятся недалеко или связаны цепью кратных связей);
·
· вторая стадия (Ka2):
НOOC—Х—СОО− → −OОC—Х—СОО− + Н+
На второй стадии эти кислоты становятся более слабыми, чем монокарбоновые кислоты (исключение — щавелевая кислота). Отделение катиона водорода второй карбоксильной группы происходит труднее, чем первой, так как требуется больше энергии, чтобы отделить H+ от аниона с зарядом −2, чем при отделении от аниона с зарядом −1;
· образование солей: в отличие от монокарбоновых кислот, дикарбоновые способны образовывать кислые соли;
· образование галогенангидридов.
В то же время есть существенные различия, обусловленные наличием второй карбоксильной группы:
· склонность к образованию хелатов;
· образование некоторыми кислотами циклических ангидридов;
· способность образовывать полимеры в реакции с другими полифункциональными соединениями.
39 Альдозами называют моносахариды содержащие альдегидную группу в открытой форме. В циклической форме альдегидная группа может находиться в замаскированном виде (полуацеталя).
Как и все углеводы обладают общей формулой C n H2 n O n (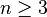 ). Альдозы являются кристаллическими веществами сладкого вкуса, растворимыми в воде.
). Альдозы являются кристаллическими веществами сладкого вкуса, растворимыми в воде.
|
|
|
Глицеральдегид является простейшим представителем альдоз. Принадлежность к альдозам обозначают с помощью приставки «альдо-». В зависимости от длины цепи различают альдогексозы, альдопентозы и т. д.
Альдозы могут существовать как в циклической (фуранозной либо пиранозной), так и в открытой формах. Альдозы могут быть превращены в кетозы с помощью реакции Лобри-де Брюйна-ван Экенстейна. 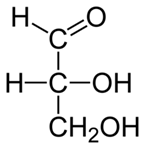 Глицериновый альдегид — простейший представитель альдоз
Глицериновый альдегид — простейший представитель альдоз
Кетозами называют моносахариды, содержащие кетогруппу в открытой форме. В циклической форме кето-группа может находиться в замаскированном виде (кеталя).
Могут существовать как в циклической (фуранозной или пиранозной), так и в открытой форме.
Простейшим представителем кетоз является дигидроксиацетон. Наиболее распространенной кетозой в природе является фруктоза.
Химические свойства
40 Углево́ды (сахара́, сахариды) — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп[1]. Название класса соединений происходит от слов «гидраты углерода», оно было впервые предложено К. Шмидтом в 1844 году. Появление такого названия связано с тем, что первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y, формально являясь соединениями углерода и воды.
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
Углеводы можно определить как альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти производные.
Согласно принятой в настоящее время классификации, углеводы подразделяются на три основные группы: моносахариды, олигосахариды иполисахариды.
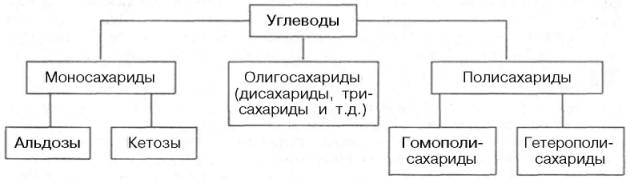
Углеводы — органические соединения, состав которых в большинстве случаев выражается общей формулой C n (H2O) m (n и m ≥ 4). Углеводы подразделяются на моносахариды, олигосахариды и полисахариды.
Моносахариды — простые углеводы, в зависимости от числа атомов углерода подразделяются на триозы (3), тетрозы (4), пентозы (5), гексозы (6) и гептозы (7 атомов). Наиболее распространены пентозы и гексозы. Свойства моносахаридов — легко растворяются в воде, кристаллизуются, имеют сладкий вкус, могут быть представлены в форме α- или β-изомеров.
|
|
|
Рибоза и дезоксирибоза относятся к группе пентоз, входят в состав нуклеотидов РНК и ДНК, рибонуклеозидтрифосфатов и дезоксирибонуклеозидтрифосфатов и др. Дезоксирибоза (С5Н10О4) отличается от рибозы (С5Н10О5) тем, что при втором атоме углерода имеет атом водорода, а не гидроксильную группу, как у рибозы.
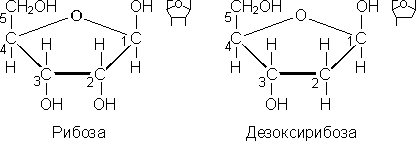
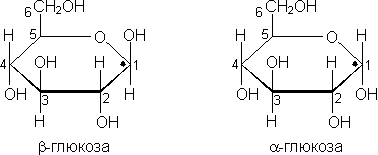
Глюкоза, или виноградный сахар (С6Н12О6), относится к группе гексоз, может существовать в виде α-глюкозы или β-глюкозы. Отличие между этими пространственными изомерами заключается в том, что при первом атоме углерода у α-глюкозы гидроксильная группа расположена под плоскостью кольца, а у β-глюкозы — над плоскостью.
42 Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатсякарбоксильные и аминные группы. Общие химические свойства
Получение
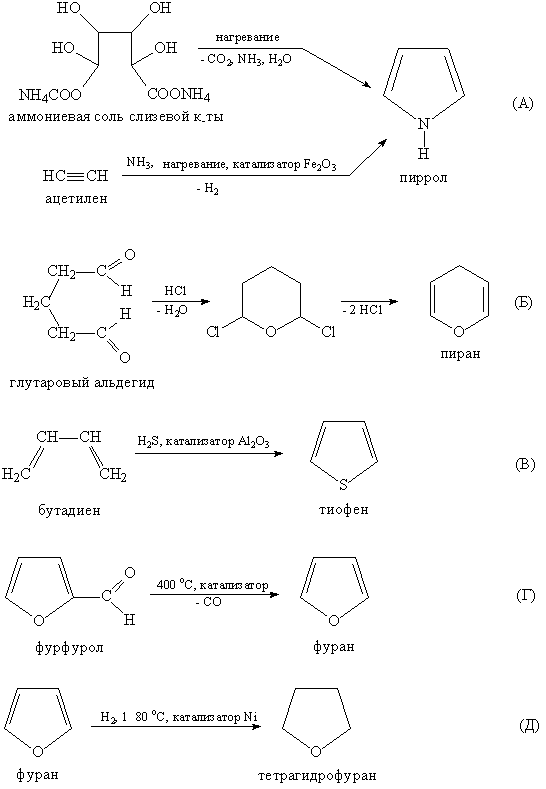
43 Пятичленные гетероциклы — органические циклические соединения, в состав которого входит как минимум один гетероатом.
Наиболее известные представители:
| Представитель | Структурная формула | Родственные соединения |
| Фуран | 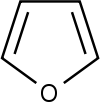
| Фурфурол, Пирослизевая кислота, Кумпарон, Изобензфуран, Тетрагидрофуран, 1,3-диоксолан |
| Тиофен | 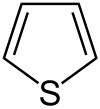
| Тионафтен, Тиофтен, Тетрагидротиофен, Тиолан, Тиоландиоксид, Биотин |
| Пиррол | 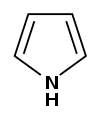
| Индол, Оксиндол, Индоксил, Изатин, Карбазол, Пирролидин, 2-пирролидон, N-метилпирролидон, Пролин |
| Оксазол | 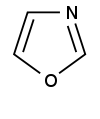
| Бензоксазол, 2-оксазолин |
| Изоксазол | 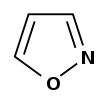
|
44 Пиридин — шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда.
В то же время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит к серьёзному перераспределению электронной плотности, что приводит к сильному снижению активности пиридина в реакциях электрофильного ароматического замещения по сравнению с бензолом. В таких реакциях реагируют преимущественно мета-положения кольца. 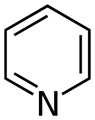
|
|
|
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по орто-пара положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
51 Поликонденсация — процесс синтеза полимеров из полифункциональных (чаще всего бифункциональных) соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды, спиртов и т. п.) при взаимодействии функциональных групп.
Молекулярная масса полимера, образовавшегося в процессе поликонденсации, зависит от соотношения исходных компонентов, условий проведения реакции.
54.Строение ДНК Строение РНК
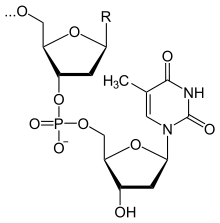
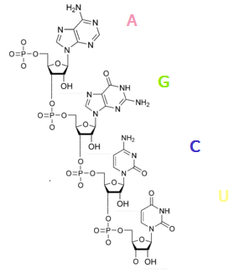
ДНК (дезоксирибонуклеиновая кислота). Сахар — дезоксирибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые — тимин (T) и цитозин (C). ДНК часто состоит из двух полинуклеотидных цепей, направленных антипараллельно. РНК (рибонуклеиновая кислота). Сахар — рибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые урацил (U) и цитозин (C). Структура полинуклеотидной цепочки аналогична таковой в ДНК. Из-за особенностей рибозы молекулы РНК часто имеют различные вторичные и третичные структуры, образуя комплементарные участки между разными цепями.
 фосфорные кислоты, нуклеиновые кислоты,
фосфорные кислоты, нуклеиновые кислоты,
P(R)3 или R1R2R3P фосфины; RP(OH)2 или R-P(O)H-OHфосфонистые к-ты
53. общее назв. процессов, протекающих с разрывом хим. связей в макромолекулах и приводящих к уменьшению степени полимеризации или мол. массы полимера.
52. Особые химические свойства:
- способность резко изменять свои физико-механические свойства под действием малых количеств реагента (вулканизация каучука, дубление кож и
51. Поликонденсация — процесс синтеза полимеров из полифункциональных (чаще всего бифункциональных) соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды, спиртов и т. п.) при взаимодействии функциональных групп.
50. Катионная полимеризация, ионная полимеризация. в которой растущий конец полимерной цепи несет положит, заряд. В катионной полимеризации наиболее активны мономеры, имеющие в α-положении к двойной связи электронодонорные заместители (напр., изобутилен. a-метилстирол, винилалкиловые эфиры, изопрен). Катионная полимеризация протекает под действием: 1) протонных кислот - НСlO4, Н3РО4, H2SO4, CF3COOH и др.; 2) апротонных кислот (к-ты Льюиса) - BF3, SbCl5, SnCl4, АlСl3, TiCl4, ZnCl2 и др.; 3) галогенов и межгалогенных соед. - I2, IC1, IВr; 4) карбениевых солей - Рb3С+А-, С7Н+7А- (здесь и ниже А-=SbCl-, PF-6 и др.); 5) алкоксикарбениевых солей - ROCH+2A-(R=СН3, С2Н5 и др.); 6) оксониевых солей - R3О+А-; 7) алкилпроизводных металлов - ZnR2, A1R3; 8) излучений высокой энергии. АНИОННАЯ ПОЛИМЕРИЗАЦИЯ, ионная полимеризация, при к-рой концевое звено растущей цепи несет полный или частичный отрицат. заряд. Процессы, развивающиеся с участием переходных металлов, относят обычно, независимо от характера поляризации связи металл-углерод, к координационно-ионной полимеризации. Радикальная полимеризация — радикально-цепной процесс полимеризации, в котором активные центры роста макромолекул являются свободными радикалами.Стадии: инициирование,термическое инициирование,фотоинициирование,радиационное иниц.,рост цепи,обрыв цепи, передача цепи.
49. Растворение полимеров с линейными гибкими молекулами сопровождается набуханием — процессом, в котором происходит не только диффузия молекул растворяемого вещества в растворителе (как у низкомолекулярных веществ), но, главным образом, диффузия молекул растворителя в высокомолекулярное соединение. Неограниченное набухание является характерным для большинства линейных полимеров, процесс набухания которых непосредственно переходит в растворение. После набухания начинается процесс взаимной диффузии макромолекул полимера в растворитель и молекул растворителя в полимер. При этом полимер из твердого (студнеобразного) состояния постепенно переходит в раствор, после растворения полимерная фаза исчезает. Ограниченное набухание— процесс взаимодействия полимеров с низкомолекудярнымн жидкостями, не сопровождающийся растворением. Это наблюдается при невысоком термодинамическом сродстве полимера и растворителя, а также характерно для полимеров, макромолекулы которых соединены прочными поперечными связями в пространственную сетку. обладают рядом особенностей по сравнению с р-рами низкомол. в-в из-за св-в макромолекул: больших размеров, широкого диапазона гибкости (жесткости), большого набора конформаций, способности к конформац. перестройкам при изменении т-ры, р-рителя и т. п. Mr(полимера)=Mr(структурного звена)*nср. Особенности растворов полимеров:
- высокая вязкость раствора при малой концентрации полимера;
- растворение полимера происходит через стадию набухания.
48.Полиэтилен: Устойчив к действию воды, не реагирует со щелочами любой концентрации, с растворами нейтральных, кислых и основных солей, органическими и неорганическими кислотами, даже с концентрированной серной кислотой, но разлагается при действии 50%-ой азотной кислоты при комнатной температуре и под воздействием жидкого и газообразного хлора и фтора. Полипропилен - химически стойкий материал. Заметное воздействие на него оказывают только сильные окислители — хлорсульфоновая кислота, дымящая азотная кислота, галогены, олеум. Каучу́ки — натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты. Полиамиды — пластмассы на основе линейных синтетических высокомолекулярных соединений, содержащих в основной цепи амидные группы —CONH—. Полиамиды используются в машиностроении, автомобильной промышленности, текстильной промышленности, медицине и других областях. Полиэфи́ры или полиэ́стеры — высокомолекулярные соединения, получаемые поликонденсацией многоосновных кислот или их альдегидов с многоатомными спиртами.
47.Структура полимеров: геометрическая(≈)целлюлоза, разветвлённые полимеры(амилопектин),сетчатые или сшитые полимеры(фенолформальдегидные смолы, резины). Твёрдые полимеры могут иметькристаллическую и аморфную структуры. Крист.стр. полимера хар-ся упорядоченным взаимнымрасположением макромолекул. Макромоле́кула — молекула с высокой молекулярной массой, структура которой представляет собой многократные повторения звеньев, образованных (в действительности или мысленно) из молекул малой молекулярной массы. Число атомов, входящих в состав макромолекул, может быть очень большим (сотни тысяч и миллионы). Стеклообразное состояние — твёрдое аморфное метастабильное состояние вещества, в котором нет выраженной кристаллической решётки, условные элементы кристаллизации наблюдаются лишь в очень малых кластерах (в так называемом «среднем порядке»). ВЯЗКОТЕКУЧЕЕ СОСТОЯНИЕ, одно из основных физ. состояний конденсиров. тел (гл. обр. линейных орг. полимеров и неорг. стекол), при к-ром они обладают текучестью, т.е. доминирующий вклад в их полную деформацию вносит необратимая составляющая.
46. По химическому составу все полимеры подразделяются на органические, элементоорганические, неорганические. По форме макромолекул полимеры делят на линейные, разветвлённые (частный случай — звездообразные), ленточные, плоские, гребнеобразные, полимерные сетки и так далее. С р е д н я я М. м. (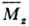 ) выражается ур-нием:
) выражается ур-нием:
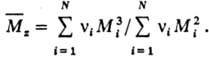
45. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (полимеры) - характеризуются мол. массой от неск. тысяч до неск. (иногда многих) миллионов.
44.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 6510; Нарушение авторских прав?; Мы поможем в написании вашей работы!