
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Клапейрона—Клаузиуса
|
|
|
|
Фазы в термодинамике
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. Поясним понятие фазы на следующих примерах. В закрытом сосуде находится вода и над ней смесь воздуха и паров воды. В этом случае мы имеем дело с системой, состоящей из двух фаз: одну фазу образует вода, вторую смесь воздуха и паров воды. Если в воду добавить несколько кусочков льда, то все эти кусочки образуют третью фазу. Различные кристаллические модификации какого-либо вещества также представляют собой разные фазы. Так, например алмаз, графит являются различными твердыми фазами углерода.
При определенных условиях разные фазы одного и того же вещества могут находиться в равновесии друг с другом, соприкасаясь между собой. Равновесие двух фаз может иметь место лишь в определенном интервале температур, причем каждому значению температур Т соответствует вполне опредёленное давление p, при котором возможно равновесие. Таким образом, состояния равновесия двух фаз изобразятся на диаграмме (р,Т) линией
p=ƒ(Т) (1.111)
Три фазы одного и того же вещества (твердая, жидкая и газообразная, или жидкая и две твердые) могут находиться в равновесии только при единственных значениях температуры и давления, которым на диаграмме (р,T) соответствует точка, называемая тройной. Эта точка лежит на пересечении кривых равновесия фаз, взятых попарно.
В термодинамике доказывается в согласии с опытом, что равновесие более чем трёх фаз одного и того же вещества невозможно.
Переход из одной фазы в другую обычно сопровождается поглощением или выделением некоторого количества теплоты, которое называется скрытой теплотой перехода, или просто теплотой перехода. Такие переходы называются фазовыми переходами первого рода.
|
|
|
Существуют переходы из одной кристаллической модификации в другую, которые не связаны с поглощением или выделением тепла. Такие переходы называются фазовыми переходами второго рода. Мы ограничимся рассмотрением только переходов первого рода.
 В предыдущих па-раграфах мы выяснили, что две любые фазы вещества могут находиться в равновесии лишь при определенном давлении, величина которого зависит от температуры. Общий вид этой зависимости можно получить, воспользовавшись понятием энтропии. Для этого рассмотрим цикл Карно для системы, состоящей из находящегося в равновесии двух фаз данного вещества.
В предыдущих па-раграфах мы выяснили, что две любые фазы вещества могут находиться в равновесии лишь при определенном давлении, величина которого зависит от температуры. Общий вид этой зависимости можно получить, воспользовавшись понятием энтропии. Для этого рассмотрим цикл Карно для системы, состоящей из находящегося в равновесии двух фаз данного вещества.
На диаграмме (р,V) цикл Карно для двухфазной системы имеет вид, показанный на рис. 1.25 (температуры нагревателя и холодильника предполагаются отличающимися на очень малую величину Δ T). Цифрами 1 и 2 помечены крайние точки горизонтального участка изотермы с температурой Т. Состояния 1 и 2 являются однофазными состояниями. Все промежуточные точки отрезка 1 и 2 изображают двухфазные состояния, отличающиеся друг от друга распределением массы вещества между первой и второй фазами.
Изотермический процесс А→В сопровождается фазовым превращением некоторой массы вещества m. При этом объем вещества получает приращение, равное 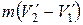 , где
, где 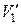 и
и 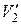 — удельные объемы первой и второй фаз. Для того чтобы такое превращение могло произойти, веществу нужно сообщить количество тепла Q1, равное
— удельные объемы первой и второй фаз. Для того чтобы такое превращение могло произойти, веществу нужно сообщить количество тепла Q1, равное 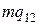 , где
, где 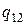 - удельная теплота, поглощаемая при переходе из состояния 1 в состояние 2 при температуре Т. Тепло Q1 представляет собой то тепло, которое получает система в ходе цикла от нагревателя. Холодильнику тепло отдается в ходе изотермического процесса С→D. Количество отданного тепла равно
- удельная теплота, поглощаемая при переходе из состояния 1 в состояние 2 при температуре Т. Тепло Q1 представляет собой то тепло, которое получает система в ходе цикла от нагревателя. Холодильнику тепло отдается в ходе изотермического процесса С→D. Количество отданного тепла равно 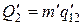 , где
, где 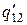 - теплота перехода 1-2 при температуре Т-DТ, а
- теплота перехода 1-2 при температуре Т-DТ, а 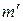 - масса вещества, претерпевающая фазовое превращение в ходе процесса С→D. Эта величина несколько отличается от m, так как некоторая масса вещества претерпевает фазовые превращения в ходе адиабатических процессов.
- масса вещества, претерпевающая фазовое превращение в ходе процесса С→D. Эта величина несколько отличается от m, так как некоторая масса вещества претерпевает фазовые превращения в ходе адиабатических процессов.
|
|
|
На изотермическом участке А-В энтропия системы получает приращение Δ S1, равное 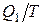 . На изотермическом участке С–D приращение энтропии равно
. На изотермическом участке С–D приращение энтропии равно 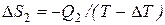 . В ходе адиабатических процессов В–С и D–А энтропия не изменяется. Полное приращение энтропии за цикл равно нулю. Следовательно,
. В ходе адиабатических процессов В–С и D–А энтропия не изменяется. Полное приращение энтропии за цикл равно нулю. Следовательно,
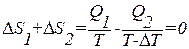 .
.
Отсюда
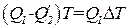 . (1.112)
. (1.112)
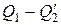 равно работе, совершаемой за цикл. Эту работу можно найти, вычислив площадь цикла. Приближенно площадь цикла можно считать равной
равно работе, совершаемой за цикл. Эту работу можно найти, вычислив площадь цикла. Приближенно площадь цикла можно считать равной 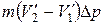 (рис. 1.25). Таким образом мы приходим к соотношению
(рис. 1.25). Таким образом мы приходим к соотношению
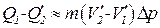 . (1.113)
. (1.113)
В пределе при Δ р, стремящемся к нулю (для чего необходимо, чтобы D Т также стремилось к нулю), соотношение (1.113) превращается в строгое равенство.
Подставим в (1.112) вместо 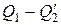 выражение (1.113). Кроме того, заменим Q 1 на
выражение (1.113). Кроме того, заменим Q 1 на 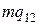 . В результате получим, что
. В результате получим, что
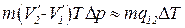 .
.
Отсюда
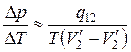 .
.
Наконец, совершив определенный переход Δ Т→0, придем к строгому равенству
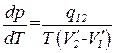 . (1.114)
. (1.114)
Полученное соотношение называется уравнением Клапейрона-Клаузиуса. Оно связывает производную от равновесного давления по температуре с теплотой перехода, температурой и разностью удельных объемов фаз, находящихся в равновесии.
Согласно (1.114) знак производной 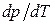 зависит от того, каким изменением объема - возрастанием или уменьшением - сопровождается фазовый переход, происходящий при поглощении тепла. При испарении жидкости или твердого тела объем всегда возрастает, поэтому производная
зависит от того, каким изменением объема - возрастанием или уменьшением - сопровождается фазовый переход, происходящий при поглощении тепла. При испарении жидкости или твердого тела объем всегда возрастает, поэтому производная 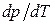 для кривой испарения, а также для кривой сублимации может быть только положительной: повышение температуры приводит к увеличению равновесного давления.
для кривой испарения, а также для кривой сублимации может быть только положительной: повышение температуры приводит к увеличению равновесного давления.
При плавлении объем, как правило, возрастает, так что 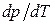 >0: увеличение давления приводит к повышению температуры плавления. Однако у некоторых веществ, к числу которых принадлежит и вода, объем жидкой фазы меньше объема твердой фазы
>0: увеличение давления приводит к повышению температуры плавления. Однако у некоторых веществ, к числу которых принадлежит и вода, объем жидкой фазы меньше объема твердой фазы 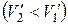 [11]. В этом случае
[11]. В этом случае 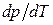 <0 - увеличение давления сопровождается понижением температуры плавления. Подвергнув лед сильному сжатию, можно, не повышая температуры выше 0°С, вызвать его плавление.
<0 - увеличение давления сопровождается понижением температуры плавления. Подвергнув лед сильному сжатию, можно, не повышая температуры выше 0°С, вызвать его плавление.
Температура перехода из одной кристаллической модификации в другую будет повышаться или понижаться с ростом давления в зависимости от того, какая из твердых фаз обладает большим удельным объемом.
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 474; Нарушение авторских прав?; Мы поможем в написании вашей работы!