
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
AMФ, ГМФ
|
|
|
|
НДФ +ATФ ® НТФ +АДФ
AMФ, ГМФ и ИМФ ингибируют ключевые реакции своего синтеза по механизму отрицательной обратной связи. Первые 2 фермента отвечают за скорость синтеза пуриновых нуклеотидов по основному пути, и их ингибирование происходит лишь при одновременном повышении концентрации
Скорость синтеза ФРДФ зависит от 2 факторов: доступности рибозо-5-фосфата и активности ФРДФ-синтетазы, регуляция активности которой имеет большее физиологическое значение, чем регуляция активности ФРДФ-амидотрансферазы.
Аденилосукцинатсинтетаза и IMP-дегидрогеназа являются регуляторными ферментами на пути превращения IMP в AMФ и ГМФ. AMФ снижает превращение IMP в аденилосукцинат, а ГМФ — превращение IMP в ксантозин –5 монофосфат, поэтому от них зависит сбалансированное содержание адениловых и гуаниловых нуклеотидов. Превращение IMP в аденилосукцинат в ходе синтеза AMФ требует ГТФ, а превращение ксантозин –5 монофосфата в ГМФ - АТФ. Перекрестная регуляция между путями использования IMP служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого.
Пуриновые нуклеотиды синтезируются «запасньм путем» из азотистых оснований и нуклеозидов. Этот путь имеет вспомогательное значение, давая от 10 до 20% общего количества нуклеотидов. При этом используются азотистые основания, образующиеся процессе катаболизма нуклеиновых кислот ( «путь спасения»). Два фермента катализируют эти реакции:
i) аденинфосфорибозилтрансфераза, отвечающая и образование AMФ из аденина и ФРДФ:
Аденин + ФРДФ ® AMP + Н4Р2О7
i) гипоксантингуанинфосфорибозилтрансфераза, которая использует в качестве субстратов гипоксантин и гуанин:
Гуанин + ФРДФ ® ГМФ
|
|
|
Гипоксантин + ФРДФ ® IMP
В результате совместного действия этих ферментов снижается выход конечного продукта обмена пуринов - мочевой кислоты.
Другой «запасной путь» включает фосфорилирование пуриновых нуклеозидов с помощью АТР. Так, аденозинкиназа катализирует фосфорилирование аденозина до AMФ или дезоксиаденозина до dAMФ:
Аденозин + АТФ ® AMФ + AДФ
Катаболизм пуриновых нуклеотидов приводит к образованию мочевой кислоты. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов.
Дальнейшие превращения аденозина и иозина в мочевую кислоту показаны на рисунке
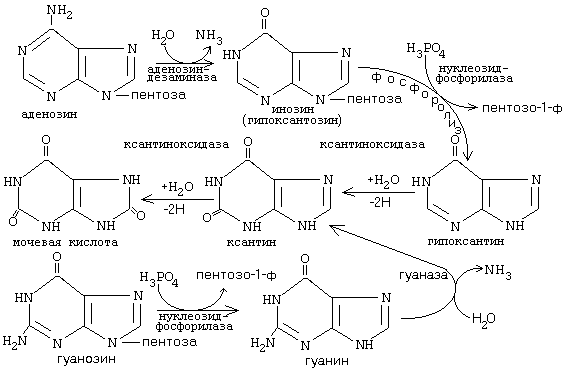
Фермент аденозиндезаминаза иногда образуется в дефектной мутантной форме, что приводит к врожденному иммунодефициту, так как нуклеотиды являются регуляторами функций лейкоцитов.
Последним ферментом, участвующим в превращении азотистых оснований в мочевую кислоту, является ксантиноксидаза. Она окисляет гипоксантин в ксантин и ксантин в мочевую кислоту с участием молекулярного кислорода. У человека мочевая кислота является конечным продуктом обмена и выводится из организма с мочой.
Мочевая кислота является одним из нормальных компонентов мочи. За сутки в организме образуется около 1 грамма мочевой кислоты. Мочевая кислота выводится из организма с мочой - это обычный ее компонент, но в почках организма человека происходит ее интенсивная реабсорбция. Концентрация мочевой кислоты в крови поддерживается на постоянном уровне 0.12-0.30 ммоль/л.
Функции мочевой кислоты: 1. Является мощным стимулятором центральной нервной системы, ингибируя фосфодиэстеразу, которая служит посредником действия гормонов адреналина и норадреналина. Мочевая кислота пролонгирует (продлевает) действие этих гормонов на ЦНС; 2. Обладает антиоксидантными свойствами - способна взаимодействовать со свободными радикалами.
|
|
|
Уровень мочевой кислоты в организме контролируется на генетическом уровне. Для людей с высоким уровнем мочевой кислоты характерен повышенный жизненный тонус
Полиморфизм ферментов, участвующих в синтезе пуриновых нуклеотидов de novo, сопровождается образованием белков с низкой ферментативной активностью или нечувствительных к действию аллостерических эффекторов. При этом нарушается регуляция синтеза пуриновых нуклеотидов по механизму отрицательной обратной связи. Избыточно синтезирующиеся нуклеотиды подвергаются катаболизму, и образование мочевой кислоты повышается. Тот же результат получается при снижении активности «путей спасения» пуринов. Аденин, гуанин и гипоксантин не используются повторно, превращаются в мочевую кислоту, и возникает гипер-урикемия. Гиперурикемия – это состояние организма, при котором содержание мочевой кислоты в сыворотке крови превышает уровень растворимости.
Сама мочевая кислота и, особенно, ее соли ураты (натриевые соли мочевой кислоты) плохо растворимы в воде. Даже при незначительном повышении концентрации они начинают начинают выпадать в осадок и кристаллизоваться, образуя камни. Кристаллы воспринимаются организмом как чужеродный объект. В суставах они фагоцитируются макрофагами, сами клетки при этом разрушаются, из них освобождаются гидролитические ферменты. Это приводит к воспалительной реакции, сопровождающейся сильнейшими болями в суставах. Такое заболевание называется подагра. Другое заболевание, при котором кристаллы уратов откладываются в почечной лоханке или в мочевом пузыре, известно как мочекаменная болезнь.
Наследственное нарушение пути реутилизации пуринов вызывает развитие у мальчиков синдрома Леша—Нихена, при котором отмечается резкое снижение активности гипоксантингуанинфосфорибо-зилтрансферазы или она полностью отсутствует. Эта патология сопровождается 3—6-кратной гиперпродукцией уратов, образованием камней в почках, умственной отсталостью, агрессивным поведением и нанесением себе увечий.
Синтез и катаболизм пиримидиновых оснований (рис.9)
Синтез УМФ de novo, включающий 6 последовательных стадий, протекает главным образом в цитозоле клеток при участии 3 ферментов, 2 из которых полифункциональны:
|
|
|
- первый полифункциональный фермент содержит домены, имеющие активность карбамоилфосфат-синтетазы II (КФС II), аспартаттранскарбамоилазы (АТК) и дигидрооротазы и катализирующие 3 первые реакции этого метаболического пути;
- митохондриальная NAD-зависимая дегидрооротатдегидрогеназа окисляет дигидрооротат в оротат;
- превращение азотистого основания оротата в нуклеотид и его последующее декарбоксилирование до УМФ катализирует второй полифункциональный фермент, обнаруживающий оротатфосфорибозилтрансферазную и оротатдекарбоксилазную активность.
НМФ- и НДФ-киназы катализируют превращение НМФ в полифосфорные производные за счет переноса фосфата АТФ на НМФ с образованием НДФ и НТФ.
СТР-синтаза (ЦТФ- синтаза) превращает УТФ в ЦТФ, используя амидную группу глутамина и энергию АТР для аминирования пиримидинового кольца.
Аллостерически регулируется активность 2 ферментов первого полифункционального комплекса:
КФС II ингибируется УТФ и пуриннуклеотидами, но активируется ФРДФ, а АТК ингибируется ЦТФ, но активируется АТФ. Количество обоих полифункциональных ферментов регулируется также на генетическом уровне путем репрессии и дерепрессии.
Подобно пуринам, пиримидиновые азотистые основания и нуклеозиды могут превращаться в нук-леотиды «запасными путями» в реакциях, катализируемых пиримидинфосфорибозилтрансферазой и ури-динцитидинкиназой.
Синтез пуриновых и пиримидиновых нуклеотидов строго координируется: ФРДФ активирует оба синтеза, а накопление пурин - и пиримидиннуклеотидов ингибирует образование ФРДФ по механизму отрицательной обратной связи.
Описано редкое наследственное заболевание — оротацидурия, при котором в результате мутации в гене второго полифункционального фермента нарушается превращение оротата в УМФ. С мочой выделяется до 1,5 г оротата (в 1000 раз больше, чем в норме), и развивается недостаточность пиримидиновых нуклеотидов.
Ферментные системы организма способны разрушать пиримидиновые основания с образованием продуктов. Цитозин распадается с образованием CO2, NH3 и b-аланина.
|
|
|
Тимин распадается подобно урацилу, но сохраняется CH3-группа, и вместо b-аланина образуется b-аминоизобутират, а также CO2 и NH3.
Поскольку тимин встречается только в ДНК, то по уровню b-аминоизобутирата в моче судят об интенсивности распада ДНК.
b-аланин хорошо растворим в воде, имеет физиологическое значение, содержится в плазме в свободном виде или включается в мышечные белки - карнозин и ансерин.
NH3 используется для синтеза мочевины.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1479; Нарушение авторских прав?; Мы поможем в написании вашей работы!