
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготування розчину перманганату калію
|
|
|
|
Щоб приготувати 1 л 0,1 н. розчину KMnO4, треба відважити на технічних терезах близько 3,2 г препарату, що становить 1/50 частину молекулярної маси. Наважку переносять у вимірювальну колбу і заливають приблизно наполовину дистильованою водою, після чого старанно перемішують до повного розчинення кристалів КМnO4. Слід мати на увазі, що ці кристали розчиняються досить повільно; кінець розчинення важко встановити через те, що розчин забарвлений в інтенсивний червонувато-фіолетовий колір. Тому завжди треба перевіряти, чи не залишились на дні колби кристалики перманганату.
Установлювати нормальність розчину перманганату за вихідною речовиною доцільно через 10—12 днів після приготування. У перші дні концентрація розчину помітно змінюється внаслідок відновлення перманганату домішками органічних речовин (пилом), які попадають у дистильовану воду з повітря. Більш стійкі розчини можна приготувати, якщо для розчинення наважки застосувати свіжоперегнану дистильовану воду. Розчин перманганату треба захищати від світла, особливо від прямих сонячних променів, тому що під дією світла відбувається самовільне відновлення КМnO4 з виділенням нерозчинного осаду MnO2. Останній каталітично прискорює відновлення перманганату при дії світла. Тому приготовлений розчин треба зберігати в склянці з темного скла, закритій скляною пробкою. Корком краще не користуватись, бо дрібні кусочки його можуть попадати в розчин і, як органічна речовина, відновлювати перманганат.
Перед встановленням нормальності розчину KMnO4 осад MnO2, який може утворитись при розкладанні перманганату під впливом світла або органічних домішок, корисно відділити фільтруванням крізь скляний фільтр або декантацією в приміщенні, вільному від пилу.
|
|
|
Вихідні речовини методу перманганатометрії. Щоб установити нормальність розчину перманганату, найчастіше користуються щавлевою кислотою або оксалатом натрію. Іноді використовують також сіль Мора — (NH4)2SO4 • FeSO4 • 6Н2O, оксид миш'яку (III) As2O3 тощо.
Щавлева кислота окислюється розчином перманганату за таким рівнянням:
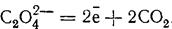
З рівняння видно, що при окисленні кожний іон С2О4 втрачає два електрони; отже, еквівалент щавлевої кислоти дорівнює половині її молекулярної маси.
Щавлева кислота кристалізується з двома молекулами води; її формула Н2С2О4 • 2Н2О. Кристалізаційна вода з часом поступово вивітрюється, тому щавлевою кислотою, яка зберігалася тривалий час, не можна безпосередньо користуватись для встановлення нормальності перманганату; щавлеву кислоту треба спочатку перекристалізувати. Для цього беруть таку наважку щавлевохїкислоти, яка потрібна для приготування насиченого розчину, розчиняють її в киплячій дистильованій воді і відфільтровують гарячий розчин від нерозчинних домішок. Гарячий фільтрат швидко охолоджують холодною водою. Дрібні кристали Н2С2О4 • 2 Н2О відділяють фільтруванням, віджимають між аркушами фільтрувального паперу і висушують на повітрі, розсипаючи тонким шаром та перемішуючи час від часу скляною паличкою. Коли окремі кристалики перестануть прилипати до палички (ознака достатнього висушування), препарат зсипають у склянку, яку добре закривають пробкою. Для встановлення нормальності розчину KMnO4 користуються 0,1 н. розчином щавлевої кислоти: 1,5600 г Н2С2О4 • 2Н2О відважують на аналітичних терезах, переносять наважку у мірну колбу на 250 мл, розчиняють її в дистильованій воді і доводять водою до риски, після чого розчин у колбі старанно перемішують.
Оксалат натрію. Хімічні реакції, які відбуваються при взаємодії розчину оксалату натрію з розчином перманганату, такі самі, як у випадку встановлення нормальності KMnO4 за щавлевою кислотою (див. нижче). Перевага оксалату натрію перед щавлевою кислотою та, що він кристалізується безводним. Тому оксалат натрію у сухому стані не зазнає ніяких змін і може зберігатись будь-який час.
|
|
|
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1792; Нарушение авторских прав?; Мы поможем в написании вашей работы!