
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сутність гравіметричного методу та сфери його застосування
Гравіметричним аналізом називають метод кількісного аналізу, який ґрунтується на обчисленні результатів зважування продукту реакції. Гравіметричні методи аналізу:
ü методи відгонки – цими методами визначають тільки леткі сполуки або такі, що перетворюються на леткі в процесі аналізу. Для цього наважку речовини зважують, висушують за певної температури і знову зважують. Вміст леткого компоненту визначають за втратою ваги. Так можна визначити вологість продовольчих товарів (наприклад, макаронних виробів, хліба тощо).
ü методи осадження – має найбільше значення, відомий з давніх часів. Ґрунтуються на переведенні речовини, що визначають, в малорозчинну сполуку, яку потім відокремлюють, зважують і за її масою обчислюють вміст компонента (елемента, речовини). Схема методу осадження така: наважку досліджуваної речовини переводять у розчин і на йон, який визначають, діють осаджувачем для отримання малорозчинної сполуки (осаджуваної форми), осад відокремлюють фільтруванням, очищають промиванням і висушують або прожарюють для отримання хімічностійкої речовини сталого складу, так званої гравіметричної форми.
Речовину, у вигляді якої визначуваний компонент виділяється в осад, називають осаджуваною формою. Сполуку, за масою якої оцінюють кількість визначуваного компонента, називають гравіметричною формою.
Різниця між осаджуваною і гравіметричною формою полягає у наступному – наприклад, при визначенні катіону Al3+ осаджуваною формою буде А1(ОН)3. Під час прожарювання цей гідроксид втрачає воду і перетворюється на оксид А12О3, який і зважують. Тобто гравіметричною формою буде А12О3, а не осаджена в процесі реакції сполука А1(ОН)3.
В окремих випадках осаджуваною і гравіметричною формою буває одна й та сама речовина. Наприклад, йони Ва2+ осаджують із розчину сульфатною кислотою у формі BaSO4. Під час прожарювання склад осаду залишається незмінним, тому і зважують Ва2+ у такій самій формі, як і осаджують.
Осаджувана форма має відповідати таким вимогам:
F осад має бути практично нерозчинним. Це означає, що в розчині після осадження визначуваного йона повинно залишатися менше, ніж можна зважити на аналітичних терезах (менше 10-4 г). М.О. Тананаєв, визначив величину розчинності, нижче, якої осад вважається практично нерозчинним. Розчинність осаду повинна бути не більшою за 10-6 моль/л. Якщо при гравіметричному визначенні утворюється осад, розчинність якого дорівнює 10-6 (або менше), то надлишок осаджувача не потрібний, і такий осад можна промивати водою. Якщо розчинність більша за 10-6, для практично повного осадження треба добавляти надлишок осаджувача, який визначають за формулою визначення добутку розчинності;
Приклад. Обчислити концентрацію йонів Ba2+, потрібну для кількісного визначення SO42--йонів.
Розв’язування: Стан рівноваги насиченого розчину барій сульфату у воді характеризується таким рівнянням:
BaSO4 (к) Ba2+(р) + SO42-(р)
Ba2+(р) + SO42-(р)
Концентрація йонів Барію така сама, як і йонів SO42-: [Ba2+] =[SO42-].
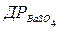 = [Ba2+][SO42-] = 1,0 × 10 -10
= [Ba2+][SO42-] = 1,0 × 10 -10
Звідси розчинність осаду, незалежно від того, через концентрацію якого з йонів її визначають, становить: [Ba2+] = 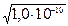 =1,0 ×10 -5 моль/л.
=1,0 ×10 -5 моль/л.
Обчислюють розчинність BaSO4 у грамах, яка складає:
m = n×M; m = 1,0 × 10 -5 × 233 = 0,00233 г BaSO4 у 1 л насиченого розчину. Хоч на осадження та промивання витрачається менше 1 л води, проте, як показують розрахунки, у цих умовах у розчині ще залишається помітна кількість йонів SO42-. Для практично повного осадження SO42- треба добавити надлишок осаджувача, тобто розчину йонів Ba2+. Концентрацію йонів Барію, яку необхідно створити в розчині, обчислюють з добутку розчинності:
[Ba2+] =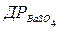 /[SO42-] = 1,0 × 10-10/10-6 = 10-4 моль/л
/[SO42-] = 1,0 × 10-10/10-6 = 10-4 моль/л
(де 10-6 моль/л – мінімальна розчинність SO42-, яка допускається за Тананаєвим).
Отже концентрація йонів Барію у розчині для промивання повинна складати 10-4 моль/л і більше. Звичайно для осадження використовують приблизно 0,1 н розчин барію хлориду, при таких умовах йонів SO42- залишається в розчині зовсім невелика кількість, а саме: [SO42-] =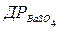 /[Ba2+] = 1,0 × 10-10/10-1 = 10-9 моль/л, тобто в 1000 раз менше від допустимої межі розчинності.
/[Ba2+] = 1,0 × 10-10/10-1 = 10-9 моль/л, тобто в 1000 раз менше від допустимої межі розчинності.
F розмір зерна осаду повинен бути більшим ніж пори фільтру (для відокремлення осаду від розчину фільтруванням). У результаті осадження мають утворюватися грубозернисті кристали, оскільки вони не забивають пори фільтра, слабко адсорбують з розчину сторонні речовини і легко відмиваються від різних забруднень. Дрібнозернисті осади можуть
проходити крізь пори фільтра, що в гравіметричному аналізі
неприпустимо. Аморфні осади, особливо драглисті, наприклад
Аl(ОН)3, схильні до вбирання з розчину сторонніх речовин, їх
важко відмити від домішок;
F легко й повністю перетворюватись на гравіметричну форму.
Гравіметрична форма має відповідати таким вимогам:
F склад осаду після висушування або прожарювання повинен відповідати певній хімічній формулі;
F бути хімічно стійкою, не бути гігроскопічною, не поглинати карбон (ІV) оксид з повітря, не окиснюватись і не відновлюватись під час прожарювання;
F відносна молекулярна маса гравіметричної форми осаду має бути якомога більшою, щоб похибка визначення якнайменше впливала на результати.
Гравіметричний аналіз застосовують:
ü у харчовій промисловості, наприклад для визначення вмісту вологи у м'ясних продуктах, молоці, сирі, крупі та хлібобулочних виробах або золи в борошні тощо;
ü у санітарно-гігієнічних дослідженнях, наприклад, визначення ступеня запилення повітря у спортивних залах, виробничих, навчальних і житлових приміщеннях;
ü для оцінки якості питної води, а саме визначення вмісту у ній нерозчинних завислих речовин.
Перевагою гравіметричного аналізу є висока точність результатів, а одним із основних недоліків – значна витрата часу на його виконання.
|
|
Дата добавления: 2014-01-04; Просмотров: 1357; Нарушение авторских прав?; Мы поможем в написании вашей работы!