
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление ОВР
|
|
|
|
В каждой окислительно-восстановительной реакции, в том числе, в реакции
Zn + CuSO4 = ZnSO4 + Cu, (1)
участвуют две окислительно-восстановительные пары
- восстановитель и его окисленная форма
Zn — Zn2+;
- окислитель и его восстановленная форма
Cu2+ — Cu.
Каждая пара имеет потенциальную возможность принимать и отдавать электроны. Мерой окислительно-восстановительной способности данной пары является окислительно-восстановительный или электродный потенциал, который обозначают 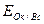 , где Ок-окисленная форма, Вс-восстановленная форма данной пары (например,
, где Ок-окисленная форма, Вс-восстановленная форма данной пары (например, 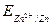 ,
, 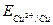 ). Размерность потенциала – Вольт. Стандартные потенциалы большого числа окислительно-восстановительных пар измерены или рассчитаны и приведе-ны в справочных таблицах. Следует отметить, что за нуль принят стандартный окислительно-восстановительный потенциал пары Н+/Н2,
). Размерность потенциала – Вольт. Стандартные потенциалы большого числа окислительно-восстановительных пар измерены или рассчитаны и приведе-ны в справочных таблицах. Следует отметить, что за нуль принят стандартный окислительно-восстановительный потенциал пары Н+/Н2, 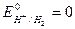 .
.
· Чем больше значение потенциала окислительно-восстановительной пары, тем более сильным окислителем является окисленная форма (Ок) данной пары. Чем меньше значение потенциала - тем более сильным восстановите-лем является восстановленная форма (Вс) окислительно-восстановительной пары. В частности, сильнейший окислитель – фтор, 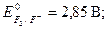 сильнейшие восстановители – щелочные металлы,
сильнейшие восстановители – щелочные металлы, 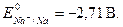
В ходе ОВР электроны всегда перемещаются от пары, содержащей восстановитель, к паре, содержащей окислитель. Обозначим
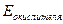 - о.-в. потенциал пары, содержащей окислитель;
- о.-в. потенциал пары, содержащей окислитель;
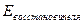 - о.-в. потенциал пары, содержащей восстано-
- о.-в. потенциал пары, содержащей восстано-
витель.
По значениям о.-в. потенциалов можно рассчитать ЭДС реакции: 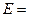
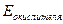 -
- 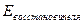 .
.
Условие самопроизвольного прохождения ОВР:
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 400; Нарушение авторских прав?; Мы поможем в написании вашей работы!