
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Структура атома лития
|
|
|
|
Математическая модель (25) Нильса Бора позволяет рассчитать спектр только водородоподобного атома лития. Спектры двух других электронов эта модель уже не рассчитывает. В результате в совокупности с уравнением Шредингера и принципом Паули модель атома лития оказывается такой (рис. 24) [6].

Рис. 24. Схема атома лития, следующая из старой теории атома
В соответствии с принципом Паули на первой S орбитали (светлая зона внутри) могут находиться только два электрона. Тогда третий электрон располагается на второй S орбитали (более тёмная зона). Никакой информации об энергиях связи электронов с ядром нет.
Наша теория атома позволяет рассчитать спектры всех электронов. Для нас важны спектры первого и второго электронов, так как спектр третьего электрона рассчитывает и формула Бора (25). Причем, наибольшую ценность имеют энергии связи электронов с ядром атома (табл. 17).
Таблица 17. Энергии связи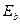 электрона атома водорода
электрона атома водорода 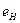 и первого, второго и третьего электронов атома лития
и первого, второго и третьего электронов атома лития 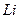 с ядром
с ядром
| n | |||||||||
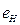
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
| 14,06 | 3,51 | 1,56 | 0,88 | 0,56 | 0,39 | 0,29 | 0,22 | 0,17 | |
| 54,16 | 13,54 | 6,02 | 3,38 | 2,17 | 1,50 | 1,10 | 0,85 | 0,67 | |
| 122,5 | 30,6 | 13,6 | 7,65 | 4,90 | 3,40 | 2,50 | 1,91 | 1,51 | |
| n | |||||||||
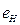
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 0,14 | 0,12 | 0,10 | 0,08 | 0,06 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,54 | 0,45 | 0,38 | 0,32 | 0,28 | 0,24 | 0,21 | 0,19 | 0,17 | |
| 1,23 | 1,01 | 0,85 | 0,72 | 0,63 | 0,54 | 0,48 | 0,42 | 0,38 |
Анализируя таблицу 17, видим близость энергий связи электрона 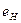 атома водорода и первого электрона атома лития на первом, втором и третьем энергетических уровнях и почти полное совпадение на всех остальных. Это – одно из доказательств того, что первый электрон атома лития взаимодействует с одним протоном ядра.
атома водорода и первого электрона атома лития на первом, втором и третьем энергетических уровнях и почти полное совпадение на всех остальных. Это – одно из доказательств того, что первый электрон атома лития взаимодействует с одним протоном ядра.
|
|
|
Нетрудно видеть, что если в атоме лития останется один (третий) электрон, то он начнет взаимодействовать сразу с тремя протонами и его энергия связи с ядром, соответствующая первому (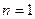 ) энергетическому уровню, определится по формуле [2], [3].
) энергетическому уровню, определится по формуле [2], [3].
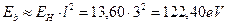 , (130)
, (130)
что совпадает со значениями этой энергии в табл. 17 и подтверждает нашу гипотезу о том, что если в атоме остаётся один электрон, то он взаимодействует одновременно со всеми протонами ядра.
Рассчитаем энергию связи третьего электрона (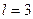 ) атома лития с ядром в момент пребывания его на 5 энергетическом уровне
) атома лития с ядром в момент пребывания его на 5 энергетическом уровне
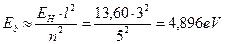 (131)
(131)
Как видно, это значение согласуется с аналогичной энергией связи третьего электрона атома лития с ядром в момент пребывания его на пятом энергетическом уровне (табл. 17). Поскольку атом лития с одним электроном – это водородоподобный атом, то для убедительности рассчитаем энергию связи второго электрона (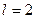 ) этого атома с ядром в момент его пребывания на седьмом энергетическом уровне [2], [3].
) этого атома с ядром в момент его пребывания на седьмом энергетическом уровне [2], [3].
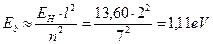 . (132)
. (132)
Этот результат также согласуется с энергией связи второго электрона атома лития в момент пребывания его на седьмом энергетическом уровне (табл. 17).
Если бы нам удалось измерить энергии связи с ядром двух остальных электронов атома лития, не удаляя из него первый электрон, то оказалось бы, что все три электрона имеют одинаковые энергии связи с ядром. Однако, постановка такого эксперимента вряд ли возможна на данном этапе научных исследований. Но гипотетическое объяснение этого явления мы уже привели [2], [3]. Совпадение результатов расчетов по формуле (132) с экспериментальными результатами, представленными в табл. 17, доказывает жизнеспособность такого объяснения.
Нетрудно представить, что различные значения энергий связи разных электронов атома лития (табл. 17), соответствующие первому энергетическому уровню (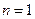 ), получаются потому, что после удаления из атома первого электрона, освободившийся протон начинает взаимодействовать со вторым электроном, увеличивая его энергию связи до величины близкой к энергии связи второго электрона атома гелия (
), получаются потому, что после удаления из атома первого электрона, освободившийся протон начинает взаимодействовать со вторым электроном, увеличивая его энергию связи до величины близкой к энергии связи второго электрона атома гелия (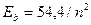 ).
).
|
|
|
После удаления из атома и второго электрона, в ядре оказывается два свободных протона, которые немедленно начинают взаимодействовать с оставшимся третьим электроном, увеличивая его энергию связи с ядром в 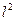 раз.
раз.
Если мы начнем последовательно возвращать все электроны в атом, то количество протонов, взаимодействовавших ранее с одним электроном, начнет уменьшаться. Уменьшится и энергия связи этого электрона до величины примерно равной энергии связи с ядром электрона атома водорода.
Из изложенного следует следующая модель атома лития (рис. 25) [2], [3]
Связь устанавливается путем взаимодействия разноименных электрических полей протонов и электронов, которые сближают их, и одноименных магнитных полюсов, которые ограничивают это сближение. Получается так, что каждый электрон взаимодействует только с одним протоном ядра атома (рис. 25).
 |
N 1
Рис. 25. Схема моделей ядра и атома лития: N - ядро атома;
1,2,3 - номера электронов
Анализ схемы на рис. 25 показывает, что симметрично расположенные электроны будут иметь одинаковые энергии связи с ядром. На электрон, расположенный справа от ядра, будут действовать электростатические силы отталкивания двух других электронов, поэтому он будет расположен дальше от ядра и его энергия ионизации будет наименьшей. Этому электрону мы присваиваем первый номер и обратим внимание на то, что энергия ионизации его (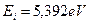 ) меньше соответствующей энергии ионизации атома водорода (
) меньше соответствующей энергии ионизации атома водорода (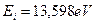 ). Схема атома лития (рис. 25) позволяет понять причину такого различия. Как видно, два симметрично расположенных осевых электрона (2 и 3) своими электростатическими полями удаляют первый электрон от ядра, уменьшая энергию его ионизации [2], [3].
). Схема атома лития (рис. 25) позволяет понять причину такого различия. Как видно, два симметрично расположенных осевых электрона (2 и 3) своими электростатическими полями удаляют первый электрон от ядра, уменьшая энергию его ионизации [2], [3].
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 631; Нарушение авторских прав?; Мы поможем в написании вашей работы!