
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи одержання двохосновних карбонових кислот
|
|
|
|
Специфічні способи одержання
1. Щавлевої кислоти
a. З мурашиної кислоти
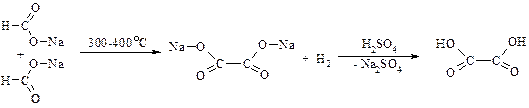
b. Окиснення етиленгліколю

2. Малонової кислоти
a. Окиснення циклопропану
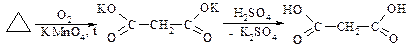
b. Гідроліз нітрилів
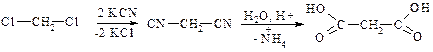
3. Бурштинової кислоти
a. Перегонка бурштину (технічний спосіб)
b. Гідроліз нітрилів
 4. Глутарової кислоти
4. Глутарової кислоти
c. Окиснення циклічного кетону циклопентанону
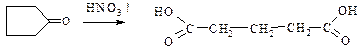
4. Адипінової кислоти
a. Окиснення відповідного циклічного кетону циклогексанону
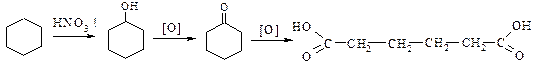
ХІМІЧНІ ВЛАСТИВОСТІ
1. Кислотні властивості.
Дикарбонові кислоти сильніші ніж моно карбонові у водному розчині вони дисоціюють:
У щавлевої кислоти сильна електроноакцепторні дія однієї карбоксильної групи на іншу полегшує дисоціацію:
Оксалат аніон стабілізований водневим зв’язком:
За першою КДИС = 1,49·10-3 малонова кислота, як і щавлева кислота сильніші за оцтову кислоту.
2. Реакції за карбоксильною групою
Двохосновні карбонові кислоти утворюють всі функціональні похідні за карбоксильною групою:
- Галоген ангідриди;
- Ангідриди;
- Аміди;
- Нітрили;
- Естери.
3. Особливості хімічних властивостей дикарбонових кислот
а) Відношення до нагрівання
1а) Щавлева і малонові кислоти при нагріванні декарбоксилюються з утворенням відповідних одноосновних кислот:
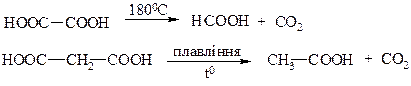
2а) Бурштинова і глутарова кислоти при нагріванні дегідратуються з утворенням відповідних циклічних ангідридів:
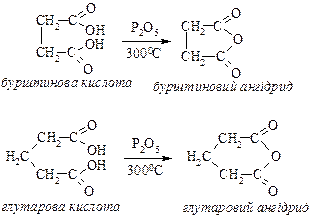
3а) Адипінова кислота і вищі кислоти при нагріванні декарбоксилюються і дегідратуються з утворенням відповідного циклічного кетону:
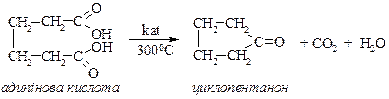
б) Синтези на основі натріймалонового естеру
Атоми водню натріймалонового естеру мають відносні кислотні властивості і легко відщеплюються у вигляді протону під дією сильних основ.
Аніон, що утворився, відносно стійкий за рахунок ефективної де локалізації електронної густини між атомом карбону і двома атомами оксігену.
|
|
|
Не дивлячись на те, що в супряженій системі малонового естеру електронна густина в основному знаходиться на атомі оксігену, як більш електронегативному елементі, при його взаємодії з алкілуючими агентами – алкілування в основному проходить за атомом карбону. Це зумовлено більшою термодинамічною вигідністю продуктів С-алкілування. На основі натрій малонового естеру можна синтезувати моно- і дикарбонові кислоти.
Приклад синтезу на основі натрій малонового естеру:
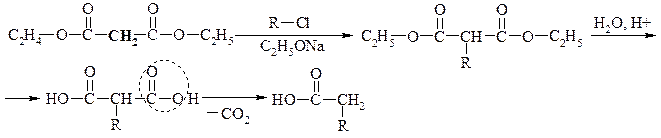

ХІМІЧНІ ВЛАСТИВОСТІ АРОМАТИЧНИХ ДВОХОСНОНИХ КАРБОНОВИХ КИСЛОТ
фталева (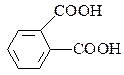 ),
),
ізофталеваи (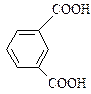 ),
),
терефталева (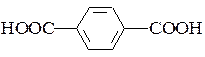 ).
).
Терефталеву кислоту використовують для добування лавсану, фталеву – гліфталевих смол.
1. Реакції за карбоксильною групою
Двохосновні ароматичні карбонові кислоти утворюють всі функціональні похідні за карбоксильною групою:
- Галоген ангідриди;
- Ангідриди;
- Аміди;
- Нітрили;
- Естери.
2. Особливості хімічних властивостей дикарбонових кислот
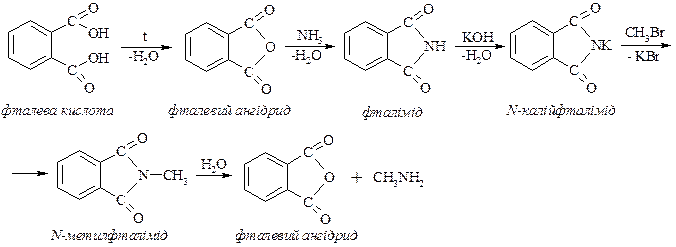
СПОЛУКИ ЗІ ЗМІШАНИМИ ФУНКЦІЯМИ
ГАЛОГЕНОЗАМІЩЕННІ КИСЛОТИ (Методи одержання)
а) a -галогенкислоти. Метод Гель-Фольгард-Зелінського
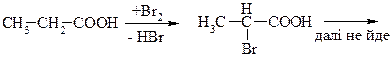
б) b-галогенкислоти. Приєднання галогеноводнів до ненасичених кислот
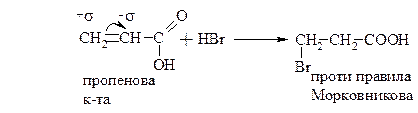
в) Ароматичні галогенкислоти.
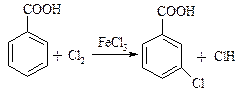
ГІДРОКСІКИСЛОТИ (Методи одержання)
a-гідроксікислоти:
а) гідроліз відповідних галогенозаміщенних кислот (див.ранішн)
б) виходячи з a-гідроксінітрилів
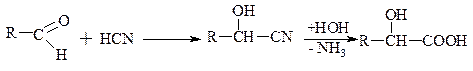
b-гідроксікислоти:
а) реакція Реформатського
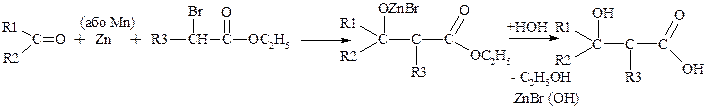
АМІНОКИСЛОТИ (Методи одержання)
1. a-амінокислот.
а) Гідроліз білків.
б) Амоноліз галоген карбонових кислот.
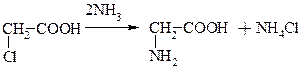
2. β-амінокислот. Приєднання аміаку до ненасичених карбонових кислот.
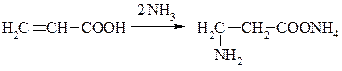
ГАЛОГЕНОЗАМІЩЕННІ КИСЛОТИ
1. Визначення. Класифікація. Номенклатура.
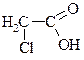
| хлороцтова, хлоретанова |
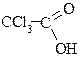
| трихлороцтова, трихлоретанова |
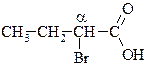
| a-броммасляна, 2-бромбутанова |
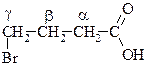
| g-броммасляна, 4 бромбутанова |
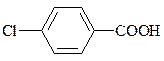
| 4-хлорбензойна |
2. Хімічні властивості
|
|
|
Мають подвійну реакційну здібність, а також деякі особливості, пов’язані з взаємним впливом атомів галогена та карбоксила.
а) Посилення кислотних властивостей
| Кислота | Ка | Кислота | Ка | Кислота | Ка |
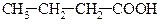
| 1,54*10-5 | 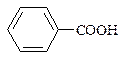
| 6,3*10-5 | 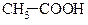
| 1,75*10-5 |
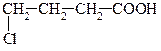
| 3,0*10-5 | 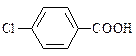
| 10,3*10-5 | 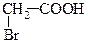
| 2,05*10-5 |
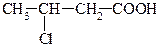
| 8,9*10-5 | 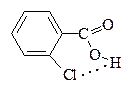
| 1,20*10-5 | 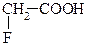
| 2,1*10-5 |
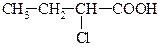
| 1,39*10-5 | 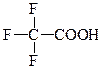
| 5,9*10-5 до 17.04.96 |
б) Збільшення рухливості галогена, особливо в l-положенні
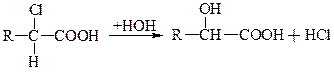
Це зручний метод отримання l-гідроксікислот.
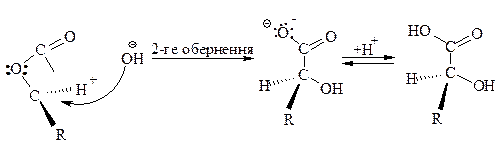
ГІДРОКСІКИСЛОТИ
1. Визначення. Класифікація. Номенклатура.
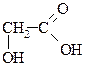
| Глікольова Гідроксітанова | 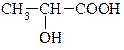
| 2-гідроксіпропанова |
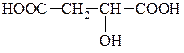
| 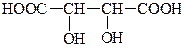
| ||
| Яблучна, 2-гідроксібутанова | Винна, 2,3-дігідроксібутанова |
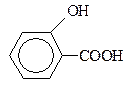 саліцилова, 2-гідроксібензойна
саліцилова, 2-гідроксібензойна
2. Хімічні властивості.
Фізичні: крист. речовини, добре розчиняються у воді, мають високі t°пл та t°к.
Хімічні: як і всі гетерофункціональні сполуки, мають подвійну реакційну здібність (проявляють властивості як спиртів, так і кислот).

Взаємний вплив гідроксила та карбоксила, найбільш сильний у a-положенні, приводить до ряду особливостей:
а) посилення кислотних властивостей
| Ка | |
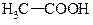
| » 10-5 |
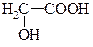
| » 10-4 |
б) При нагріванні з розб. мінер. кислотами a; гідроксікислотами розщепляються по a-зв’язку, який є найбільш послабленим (найбільш розрихленим).
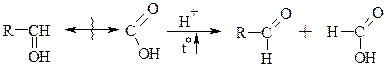
При нагріванні всі гідрокислоти легко відщепляють воду (вони самі по собі створюють досить кисле середовище, яке каталізує дегідратацію). Ця реакція дозволяє розрізнити одна від одної a, b та g-гідроксікислоти
a-гідрокислоти
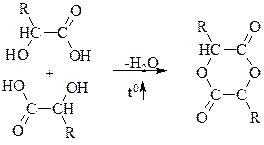
лактид
b-гідрокислоти
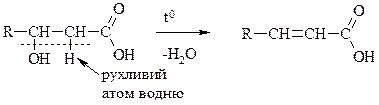
g- та S-гідроксікислоти
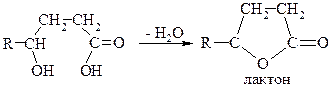
Остання реакція йде настільки легко, що часто спостерігається при простому підкисленні водного розчину солі відповідної кислоти. e-гідроксікислоти та інші, ще з більше віддаленим гідроксилом, доють звичайно не лактони, а міжмолекулярні лінейні поліестери.
Серед гідроксікислот часто зустрічаються сполуки, цо мають оптичну активність, тоб-то спроможні існувати у вигляді опричних ізомерів.
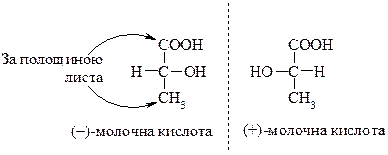
Далі про суть опичної активності.

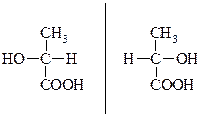
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 7293; Нарушение авторских прав?; Мы поможем в написании вашей работы!