
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория электролитов Дебая и Гюккеля
|
|
|
|
Распределение ионов в растворе
В теории электролитов очень важным является вопрос о распределении ионов в растворе. По первоначальной теории электролитической диссоциации, основанной на физической теории растворов Вант-Гоффа, считалось, что ионы в растворах находятся в состоянии беспорядочного движения - в состоянии, подобном газообразному.
Однако представление о беспорядочном распределении ионов в растворе не соответствует действительности, так как онo не учитывает электростатического взаимодействия ионов. Электрические силы проявляются на относительно больших расстояниях, и в сильных электролитах, где диссоциация велика, а концентрация ионов значительна и расстояния между ними невелики, электростатическое взаимодействие ионов настолько сильно, что оно не может не сказываться на характере их распределения. Возникает тенденция к упорядоченному распределению, аналогичному распределению ионов в ионных кристаллах, где каждый ион окружён ионами противоположного знака.
Распределение ионов будет определяться соотношением электростатической энергии и энергии хаотического движения ионов. Эти энергии сравнимы по величине, поэтому реальное распределение ионов в электролите является промежуточным между беспорядочным и упорядоченным. Около каждого иона образуется своеобразная ионная атмосфера, в которой преобладают ионы противоположного (по сравнению с центральным ионом) знака. В этом заключается своеобразие электролитов и трудности, возникающие при создании теории электролитов.
Лекция 49
Основные положения современной теории растворов электролитов были сформулированы в 1923 г. Дебаем и Гюккелем. Для статистической теории электролитов исходным является следующее положение: ионы распределены в объеме раствора не хаотически, а в соответствии с законом кулоновского взаимодействия. Вокруг каждого отдельного иона существует ионная атмосфера (ионное облако) - сфера, состоящая из ионов противоположного знака. Ионы, входящие в состав сферы, непрерывно обмениваются местами с другими ионами. Все ионы раствора равноценны, каждый из них окружен ионной атмосферой, и в то же время каждый центральный ион входит в состав ионной атмосферы какого-либо другого иона. Существование ионных атмосфер и есть тот характерный признак, который, по Дебаю и Гюккелю, отличает реальные растворы электролитов от идеальных.
|
|
|
Энергия, связанная с ионной атмосферой, имеет электрическое происхождение, поэтому она должна быть функцией плотности электрического заряда и потенциала, создаваемого ионной атмосферой. Тепловое движение ионов в ионной атмосфере приводит к тому, что дискретные заряды этих ионов как бы размазываются. В результате ионную атмосферу, состоящую из отдельных ионов, в среднем за некоторый промежуток времени можно моделировать облаком размазанного заряда, плотность которого r уменьшается по мере удаления от центрального иона. Для связи между средней плотностью заряда r и отвечающим ему средним значением потенциала y можно использовать уравнение Пуассона
Ñ2y = – 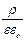 ,
,
где Ñ2 – оператор Лапласа Ñ2 = 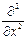 +
+ 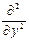 +
+ 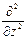 .
.
Поскольку ионная атмосфера обладает шаровой симметрией, то уравнение Пуассона, записанное в сферической системе координат, принимает вид
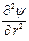 +
+ 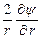 = –
= – 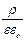
и связывает объемную плотность заряда r с потенциалом y на расстоянии r от центрального иона. В уравнение Пуассона входят две неизвестные величины: r и y. Для их определения необходимо иметь второе уравнение, связывающее обе эти переменные. Дебай и Гюккель получили нужное уравнение следующим образом.
|
|
|
Для раствора в целом и для любого заданного его объема, достаточно большого по сравнению с размерами иона, справедливо условие электронейтральности
å ni ezi = 0,
где ni – число ионов i- го сорта в единице объема (если выбран объем раствора, равный единице). Однако заряд некоторого элемента объема dV, находящегося вблизи какого-либо иона, будет отличаться от нуля вследствие существования ионной атмосферы. Если центральный ион, расположенный в начале координат, заряжен положительно, то элемент объема dV будет обладать избыточным отрицательным зарядом. Предполагая, что к распределению ионов в растворе применим принцип Больцмана и что силы, действующие между ионами, по своей природе электростатические, число отрицательных и число положительных ионов в элементарном объеме dV можно выразить как
d n – = n – 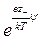 dV, d n + = n +
dV, d n + = n +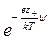 dV.
dV.
Заряд элемента объема будет равен
rdV = ez – n – exp 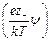 dV – ez + n + exp
dV – ez + n + exp 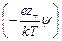 dV,
dV,
а плотность заряда
r = ez – n – exp 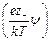 – ez + n + exp
– ez + n + exp 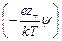 =
=
= e å zi ni exp 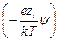
(учитывая, что в растворе находятся различные ионы, и приписывая zi знак, отвечающий заряду иона). Подстановка r из этого выражения в уравнение Пуассона дает уравнение, которое в общем виде нельзя проинтегрировать. Чтобы упростить его, Дебай и Гюккель предположили, что ezi y << k T, то есть что электростатическое взаимодействие мало по сравнению с термической энергией. Разложив показательную функцию в ряд
exp 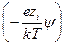 = 1 –
= 1 – 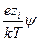 +
+ 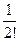
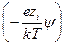 2 + …,
2 + …,
они ограничились только двумя его первыми членами, получив для r следующее уравнение:
r = e å zi ni – 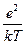 å zi2 ni y = –
å zi2 ni y = – 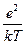 å zi2 ni y
å zi2 ni y
(так как первый член правой части уравнения по условию электронейтральности равен нулю). Если ввести обозначение
c = 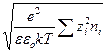 ,
,
то после подстановки выражения для r в уравнение Пуассона получаем дифференциальное уравнение вида
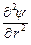 +
+ 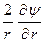 = c2 y.
= c2 y.
Общее решение этого уравнения второго порядка имеет вид
y = А1 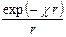 + А2
+ А2 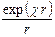 .
.
Константы интегрирования А1 и А2 находят из пограничных условий. Как следует из основных законов электростатики, при r ® ¥ y ® 0; это условие выполняется в том случае, если А2 = 0, так как иначе с удалением от центрального иона y будет стремиться к бесконечности. Для определения А1 в первом приближении теории Дебая – Гюккеля предполагается, что ионы можно отождествить с материальными точками, обладающими определенным зарядом. В этом случае при r ® 0 y должен стремиться к потенциалу самого иона y i, то есть
|
|
|
y r ® 0 = y i = 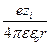 ,
,
что является вторым пограничным условием. Если е –c r разложить в ряд, то получим
y = А1 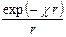 = А1
= А1 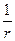 (1 – c r +
(1 – c r + 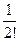 (c r)2 – …).
(c r)2 – …).
При r ® 0 всеми членами ряда можно пренебречь по сравнению с 1. Тогда
y r ® 0 ® y i = А1/ r, A1 = 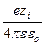 , y =
, y = 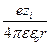 exp (–c r).
exp (–c r).
Величина y в последнем уравнении представляет собой среднее значение потенциала в точке r, создаваемое ионной атмосферой и центральным ионом. Для вычисления ион-ионного взаимодействия представляет интерес не общий потенциал y, а та его часть y а, которая создается ионной атмосферой в месте расположения центрального иона. y а называется потенциалом ионной атмосферы. Его находят по правилу суперпозиции (то есть наложения) потенциалов
y а = y – y i = 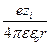 (exp (–c r) – 1).
(exp (–c r) – 1).
Для вычисления энергии взаимодействия необходимо определить потенциал ионной атмосферы в точке нахождения центрального иона, то есть найти предел y а при r ® 0. Это можно сделать, используя тот же прием – разлагая показательную функцию в ряд и пренебрегая высшими членами разложения:
lim y а = y¢ = – 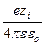 c.
c.
Величину y¢ можно рассматривать как потенциал, создаваемый в точке нахождения центрального иона другим ионом с противоположным знаком, находящимся от центрального иона на расстоянии 1/c. Величина 1/c называется характеристической длиной. Так как потенциал создается не единичным ионом, а всей ионной атмосферой, то 1/c можно отождествить с радиусом ионной атмосферы. Величину c можно рассчитать по вышеприведенному уравнению.
В первом приближении теории Дебая и Гюккеля предполагается, что энергия межионного взаимодействия имеет электростатическое происхождение. Энергия взаимодействия ионов может быть определена поэтому как энергия заряжения центрального иона в электрическом поле ионной атмосферы. Известно, что энергия заряжения частицы от 0 до заряда q в поле y равна
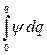 =
= 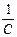
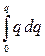 =
= 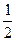
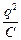 =
= 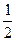 qy =
qy = 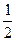 ezi (–
ezi (– 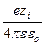 c) =
c) =
= – 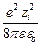 c
c
(вместо q подставили заряд центрального иона, а вместо y – величину y¢).
Найдем выражение для коэффициента активности электролита. Коэффициенты активности первоначально были введены как эмпирические величины; необходимость их введения в уравнения для идеальных систем обусловлена различием между реальными и идеальными растворами. Коэффициенты активности не зависят от метода их определения и при заданных условиях и составе будут иметь одно и то же значение для любых типов равновесия. Таблицы, в которых приведены эмпирические коэффициенты активности, представляют большую ценность. В то же время в пределах теории Льюиса коэффициенты активности оказываются лишь формальными поправочными множителями, не связанными непосредственно с природой растворов и не поддающимися теоретическим расчетам.
|
|
|
Реальные растворы отличаются от идеальных энергией взаимодействия образующими их частиц. Сопоставление выражений для химических потенциалов частиц в реальных растворах
m i = m i o + RT ln N i + RT ln g i
и в идеальных растворах
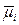 = m i o + RT ln N i
= m i o + RT ln N i
показывает, что
RT ln g i = m i – 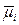 = Dm i.
= Dm i.
Таким образом, коэффициент активности отражает изменение энергетического состояния ионов, обусловленное межионным (межчастичным) взаимодействием. Расчет взаимодействия, а следовательно, и коэффициента активности возможен, если известны структура раствора и природа сил взаимодействия между образующими его частицами. Ни то, ни другое не известно с достаточной степенью точности, поэтому для решения проблемы приходится прибегать к некоторым предположениям и создавать модели растворов электролитов.
По модели Дебая и Гюккеля, энергия взаимодействия иона с ионной атмосферой, равная энергии заряжения, определяется выражением
Dm i = – NA 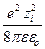 c.
c.
Для коэффициента активности
ln g i = – NA 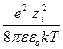 c.
c.
Подстановка значения c приводит к
ln g i = – NA 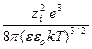
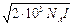 ,
,
где I – ионная сила раствора, определяемая соотношением
I = 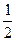 å сi zi 2.
å сi zi 2.
(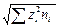 =
= 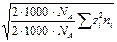 =
= 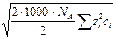 =
=
= 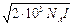 ;
;
[ ni ] = ион /м 3; [ ni / NA ] = моль / м 3; [ ni /(1000× NA) = ci ] = моль/л).
После перехода к десятичному логарифму и подстановки численных значений постоянных величин
lg g i = – 1,8246×106 (eT)– 3/2 zi 2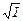 .
.
Для данного растворителя и определенной Т можно написать
lg g i = – zi 2 h 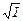 .
.
Для среднего ионного коэффициента активности, который в отличие от коэффициента активности отдельного вида ионов определяется экспериментально, справедливо уравнение
lg g± = – ï z+× z –ï h 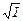 . (1)
. (1)
Для водных растворов при 25оС, допуская равенство диэлектрических проницаемостей раствора и растворителя (78,54), h = 0,51. Для 1-1 зарядных электролитов
lg g± = – h 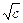 = – 0,51
= – 0,51 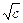 .
.
Сопоставление теории Дебая – Гюккеля с опытом
Таким образом, теория Дебая и Гюккеля позволяет получить такое же уравнение для коэффициента активности, какое было эмпирически найдено для разбавленных растворов электролитов. Из уравнения (1) следует, что коэффициенты активности в растворах с одинаковой ионной силой должны быть одинаковыми. Это согласуется с законом ионной силы Льюиса – Рендалла, который был открыт раньше, чем была создана теория Дебая и Гюккеля. Теория передает зависимость коэффициентов активности в разбавленных растворах от валентного типа электролита и от температуры. Теория, следовательно, находится в качественном согласии с опытом.
Используя выражение для коэффициента активности, можно рассчитать все парциальные термодинамические характеристики раствора (мольную энтропию, мольный объем, теплоемкость, сжимаемость, термическое расширение и т.д.). Теория Дебая и Гюккеля позволила предсказать эффект выделения теплоты при разбавлении растворов электролитов, вызванный тем, что при разбавлении уменьшается взаимодействие ионов. Учитывая, что вышеприведенные уравнения не содержат эмпирических параметров, успехи теории Дебая – Гюккеля следует признать весьма значительными.
При разработке этой теории были сделаны следующие допущения:
1. Число ионов в электролите можно определить из аналитической концентрации электролита, так как он считается полностью диссоциированным (a = 1). Теорию Дебая и Гюккеля поэтому иногда называют теорией полной диссоциации. Однако ее можно применить и в тех случаях, когда a ¹ 1.
2. Распределение ионов вокруг любого центрального иона подчиняется классической статистике Максвелла – Больцмана.
3. Собственными размерами ионов можно пренебречь по сравнению с расстояниями между ними и с общим объемом раствора. Таким образом, ионы отождествляются с материальными точками, и все их свойства сводятся лишь к величине заряда. Это допущение справедливо только для разбавленных растворов.
4. Взаимодействие между ионами исчерпывается кулоновскими силами. Наложение сил теплового движения приводит к такому распределению ионов в растворе, для которого характерна статистическая шаровая ионная атмосфера. Это допущение справедливо лишь для разбавленных растворов. При повышении концентрации среднее расстояние между ионами уменьшается, и наряду с электростатическими силами появляются другие силы, действующие на более близком расстоянии, в первую очередь, силы Ван-дер-Ваальса. Возникает необходимость учета взаимодействия не только данного иона и его окружения, но и любых двух соседних ионов.
5. При расчетах принимается, что диэлектрические проницаемости раствора и чистого растворителя равны; это справедливо только в случае разбавленных растворов.
Таким образом, три последних допущения Дебая и Гюккеля приводят к тому, что их теория может быть применима только к разбавленным растворам электролитов с ионами низкой валентности. Уравнение (1) соответствует этому предельному случаю и выражает так называемый предельный закон Дебая и Гюккеля или первое приближение теории Дебая и Гюккеля.
Предельный закон Дебая – Гюккеля дает верные значения коэффициентов активности 1-1 зарядного электролита, особенно в очень разбавленных растворах (с £ 0,01 моль/л). Сходимость теории с опытом ухудшается по мере увеличения концентрации электролита, увеличения зарядов ионов и уменьшения диэлектрической проницаемости растворителя, то есть с ростом сил взаимодействия ионов.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 829; Нарушение авторских прав?; Мы поможем в написании вашей работы!