
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вынос сернистых соединений, их расчёт и способы сокращения выбросов оксидов серы
|
|
|
|
Тема 5
Перспективы развития представлений в катализе и разработке на их основе эффективных каталитических систем, обеспечивающих высокий уровень ресурсосбережения и экологической безопасности химико-технологических процессов
Дилемма выбора между гомогенными и гетерогенными катализаторами.
Преимущества гомогенных катализаторов – эффективность, мягкие условия, легкость управления. Недостатки – однократность использования катализатора или необходимость его регенерации, наличие сточных вод в результате регенерации или нейтрализации. Гетерогенные катализаторы менее эффективны, так как не все активные центры участвуют в актах катализа; реакции осложняются диффузионным торможением, характеризуются неизотермичностью как результат недостаточно эффективного теплообмена при подводе или отводе тепла, трудностями управления, низкой селективностью.
В этой связи перед разработчиками новых каталитических систем ставится ряд задач.
1. Создание эффективных и легко регенерируемых гомогенно-каталитических систем.
Успех регенерации таких систем связан с возможностью перевода катализаторов в другую фазу, благодаря чему открывается возможность легкого и дешевого отделения катализатора от реакционной массы.
Примером подобной системы, нашедшей практическое воплощение, являются кобальтовые катализаторы реакции гидроформилирования
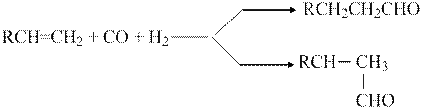
| (1) |
Исходной формой катализатора является металлический кобальт, который переводится в активную форму гидрокарбонила кобальта под действием температуры и высокого давления СО

| (2) |
Процессы гидроформилирования и регенерации катализатора осуществляются по триадной схеме, представленной ниже
|
|
|
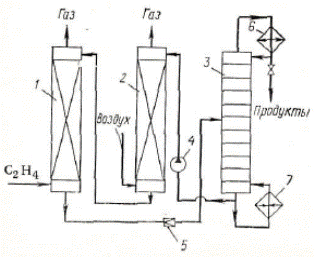
| Рис. 1. Схема реакционного узла триадной схемы гидроформилирования низших алкенов 1 – катализатор, 2 – реактор, 3 – декатализер |
Реакционный узел состоит из трех колонн, рассчитанных на высокое давление. Две из них (1 и 3) заполнены пористой насадкой (например, пемзой), а третья (2) является реактором, представляющим пустотелую барботажную колонну с охлаждающими устройствами. Колонны с насадкой (1 и 3) – катализер и декатализер. В первой из них, где находится насадка с нанесенным на нее металлическим кобальтом, подают растворитель и небольшую часть СО и Н2. Металлический СО при этом переходит в растворимый гидрокарбонил под действием высоких давлений и умеренных температур. Полученный катализаторный раствор поступает в реактор, куда также подаются другие реагенты (олефин и большая часть синтез-газа). По выходе из реактора реакционная масса подвергается дросселированию и направляется в декатализер, где при подаче водорода карбонилы в соответствии с равновесием (2) распадаются и кобальт адсорбируется на насадке. По исчерпании металла в катализере и его накоплении в декатализере потоки реагентов переключаются, декатализер начинает выполнять функцию катализера и наоборот. Недостатками представленной схемы являются цикличность работы, усложняющая автоматизацию, и большие капитальные затраты.
Более совершенная схема реализована в процессе карбонилирования метанола
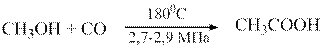
| (3) |
катализируемого комплексом Rh(CO)2J2. После получения уксусной кислоты органическая масса подвергается дросселированию с отводом большей части продуктов в паровой фазе на дальнейшее разделение. Кубовая жидкость, содержащая основной компонент катализатора остается в реакторе и используется в следующем технологическом цикле. Этот процесс – самый экономичный метод получения уксусной кислоты.
|
|
|
Следующими примерами современного процесса, в которых реализована схема, сочетающая каталитический процесс с регенерацией катализатора являются окисление и окислительное сочетание этилена. Особенность процесса – отсутствие необходимости фазового разделения и возможность организации непрерывного процесса
| CH2=CH2 + ½O2 ® CH3CHO | (1) |
| CH2 = CH2 + ½O2 + CH3COOH ® CH2=CH–OOCCH3 + H2O | (2) |
Одним из вариантов окисления этилена является двухступенчатый реакционный узел. На первой ступени осуществляются реакции палладий-содержащего компонента катализатора с этиленом
| CH2= CH2 + PdCl2 + H2O ® CH3CHO + Pd + 2HCl | (3) |
и быстрая регенерация исходной формы палладия под действием второго компонента каталитической системы – CuCl2
| Pd + 2CuCl2 ® PdCl2 + 2CuCl | (4) |
На второй ступени восстановленная форма медь-содержащего компонента окисляется кислородом воздуха
| 2CuCl + ½O2 + 2HCl ® 2CuCl2 + H2O | (5) |
Можно показать, что суммирование реакций (3) – (5) дает стехиометрическое уравнение процесса (1).
Реакционный узел, содержащий обе ступени предоставлен на рис. 2.
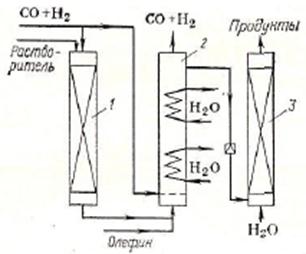
| Рис. 2. Схема реакционного узла синтеза ацетальдегида каталитическим жидкофазным окислением этилена 1 – реактор окисления этилена, 2 – реактор регенерации каталитической системы, 3 – колонна дистилляции, 4 – дроссельный вентиль, 5 – конденсатор, 6 – испаритель |
В реактор 1 с кислотоупорной насадкой подают этилен и регенерированный катализаторный раствор, причем реакцию ведут до почти полной конверсии этилена при 0,8–0,9 МПа и 100–1150С. Полученный раствор ацетальдегида с восстановленным катализатором дросселируют и направляют в колонну дистилляции 3, где отгоняют ацетальдегид и растворенные газы, поступающие на дальнейшее разделение. Катализаторный раствор с низа колонны подают насосом при» 1МПа в регенератор 2; туда также вводят воздух, окисляющий CuCl в СuCl2. Регенерированный раствор возвращают в реактор 1. Достоинства этого процесса – его безопасность (из-за раздельной подачи этилена и окислителя), использование воздуха в качестве окислителя, оптимальные режимы на каждой ступени. Процесс характеризуется высоким выходом (95%) и конверсией (99%).
|
|
|
Следующий вариант сочетания достоинств гомогенного и гетерогенного катализаторов – использование катализаторов межфазного переноса, когда реагенты находятся в разных фазах. Типичным примером таких процессов является гидролиз хлорпроизводных углеводородов. Успех этого процесса определяется интенсивностью массообмена между органической и водной фазами. Для подобных реакций предложены катализаторы межфазного переноса, представляющие собой соли или основания четвертичного аммония, в которых одна из алкильных групп представляет собой достаточно длинную углеводородную цепь. Основание R(CH3)3NOH лучше растворимо в органической фазе и выступает в качестве нуклеофила по отношению к хлорорганическому субстрату в ней
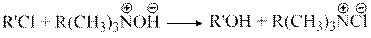
|
| Образующаяся соль | 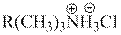
| , обладая более высокой |
полярностью, легче растворяется в воде и после образования легко переходит в водную фазу, где под воздействием щелочи вновь образует четвертичное аммониевое основание
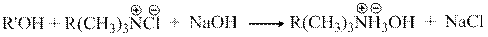
|
быстро диффундирующее в органическую фазу и возобновляющее новый каталитический цикл.
2. Создание гомогенно-гетерогенизированных каталитических систем
на основе новых методов нанесения активного компонента катализатора
В этом плане можно выделить следующие типы нанесения катализаторов на поверхности:
а) получение кислотных катализаторов нанесением на синтетические смолы сульфогрупп

б) получение основных катализаторов, содержащих аминогруппы, например, в поливинилпиридине
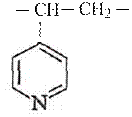
Подобного рода катализаторы набухают в реакционной массе и каталитические центры становятся доступными для эффективного осуществления их функции. Они показали свою эффективность в жидкофазном процессе гидратации пропилена при получении изопропилового спирта
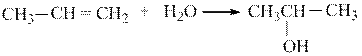
в) топологическое закрепление. Этот вид закрепления заключается в синтезировании в полостях цеолитов комплексов металлов, являющихся каталитическими реакционными центрами, неспособными по геометрическим причинам выйти за пределы этих полостей. В то же время размер устья полости позволяет реагентам легко достигать реакционного центра, а продуктам – диффундировать обратно (А)
|
|
|
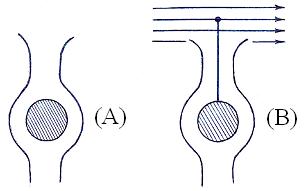
г) якорно-топологическое закрепление каталитических компонентов (В). Этот вид предполагает комбинацию якоря, закрепленного в полости цеолита и вынесенного в объем реакционной зоны активного центра, соединенных между собой олигомерной цепью.
д) проведение каталитических процессов в суперкритических (СК) условиях.
Современные представления трактуют сверхкритическое состояние как систему, содержащую свободные молекулы и многочисленные слабо связанные кластеры молекул. Расстояния между присутствующими в сверхкритической фазе частицами (молекулами и кластерами) значительно больше, чем в классической жидкости, но намного меньше, чем в обычных газах. Из-за низких энергий связывания молекул в кластерах, последние с высокими скоростями покидают их и, наоборот, входят в них. Отсюда вытекает исключительно низкая вязкость и одновременно высокая диффузионная способность сверхкритической среды.
Отмеченные свойства СК сред позволили в ряде случаев эффективно осуществить некоторые важные каталитические процессы. Так, японская корпорация «Research Development Corporation» разработала процесс каталитического гидрирования CO2 в СК–СО2, приводящий к образованию муравьиной кислоты

|
Процесс протекает очень быстро и селективно. Этот феномен обусловлен большим свободным объемом в сверхкритическом СО2, что приводит к резкому увеличению растворимости Н2 в нем.
Для сравнения приведем традиционный метод получения муравьиной кислоты, основанный на взаимодействии СО с NaOH
| CO + NaOH ® HCOONa |
| 2HCOONa + H2SO4 ® HCOOH + Na2SO4 |
Очевидные недостатки этого метода – расход дорогостоящих реагентов, коррозия аппаратуры, двухстадийность, наличие сточных вод.
С другой стороны, состояние реагентов в сверхкритических условиях открывает новые возможности для интенсификации других гетерогенных и гетерофазных каталитических реакций. Это связано со следующими причинами: (1) неограниченная смешиваемость реагентов, трудно растворимых друг в друге в обычных условиях, (2) возможность экстракции и удаления с поверхности катализатора продуктов, способных вовлекаться в побочные реакции. Так, в реакциях гидролиза галогеналканов возможно достижение полной гомогенизации системы органическая масса – вода, благодаря резкому снижению диэлектрической проницаемости последней, что обеспечивает высокую производительность процесса. Эффект экстрагирования продуктов с поверхности катализатора в реакциях изомеризации, алкилирования, крекинга, ароматизации снижает степень вовлечения этих продуктов во вторичные побочные реакции, включая карбонизацию каталитической поверхности. Это приводит к увеличению срока службы катализатора и росту селективности процесса:
е) разработка эффективных фотокаталитических систем.
Фотокатализ – явление индуцирования химических превращений под действием света на системы, содержащие химические соединения – участники реакции и вещества – фотокатализаторы, которые, поглощая свет, инициируют химические превращения участников реакции, многократно вступая с ними в химические взаимодействия и регенерируясь после каждого цикла превращений.
Классический пример – реакция фотосинтеза

Более 90% хлорофилла растительной клетки входят в состав хлорофилл-белковых комплексов, выполняющих функцию фотосенсибилизатора (S) и обеспечивающих эффективное поглощение солнечного излучения и их электронное возбуждение. Эти комплексы выполняют роль своеобразной антенны для улавливания солнечного света, характеризующегося относительно низкой плотностью потока энергии на единицу поверхности. Энергия электронного возбуждения антенных комплексов с эффективностью, близкой к 100%, передается димеру хлорофилла P(S* + P ® P* + S), входящему в состав реакционного центра и выполняющему функцию фотокатализатора суммарного процесса переноса электронов от воды к никотинамидадениндинуклеотид фосфату (NADP+)
2H2O + 4NADPÅ + 8hν ® O2 + 4NADPH
Восстановленная форма NADPH участвует в дальнейших темновых биохимических реакциях, приводящих к образованию органических соединений из углекислого газа.
Основная проблема создания эффективных фотокаталитических
систем – увеличение селективности светопоглощения.
Одним из немногочисленных примеров использования фотокатализа в практике – разложение органических отходов в сточных водах на ТiO2.
ж) использование ионных жидкостей и перфторуглеводородов в качестве реакционной среды для гомогенных металлокомплексных катализаторов.
Ионные жидкости (ИЖ) представляют собой четвертичные аммониевые соли, например. NBu4Br. В одной фазе (ИЖ) находится катализатор, в другой – органические реагенты. По окончании реакции катализаторная масса остается в ИЖ, а органическая отводится на переработку и разделение. Для более эффективного разделения раствор катализатора в ИЖ подвергается дополнительной экстракции органическим растворителем. Подобные системы успешно апробированы в ряде реакций гидрокарбоксилирование:
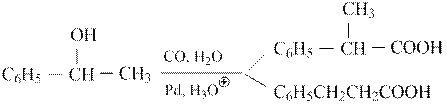
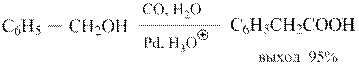
и синтезе Фишера-Тропша


Использование перфторуглеводородов в качестве реакционной среды основано на резком изменении их растворяющей способности по отношению к органическим соединениям и катализаторам с изменением температуры. Это открывает возможность проведения реакции в гомогенных условиях при повышенных температурах с последующим разделением фаз при понижении температуры.
з) переход к мультикомпонентным гомогенно-гетерогенизированным структурно-организованным каталитическим системам.
Примером таких систем может служить закрепленные на поверхности твердых носителей (силикагель, алюмосиликаты, оксид алюминия)
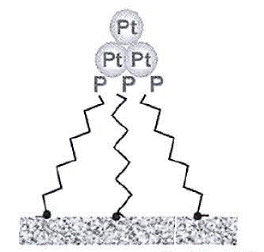
| комплексов металлов платиновой группы с фосфинами. При этом достигается 100%-ная дисперсность металла на поверхности. Это обеспечивает высокую активность катализатора, низкие температуры и высокую селективность. Другой пример – получение гигантских кластеров поздних переходных металлов, стабилизированных О-содержащими анионами переходных металлов и |
фосфора (вольфраматы, ниобаты, фосфаты), а также катионами тетраалкиламмония и натрия. Такие кластеры очень стабильны и могут существовать годами, но их можно отделить от продуктов реакции утльтрафильтрацией.
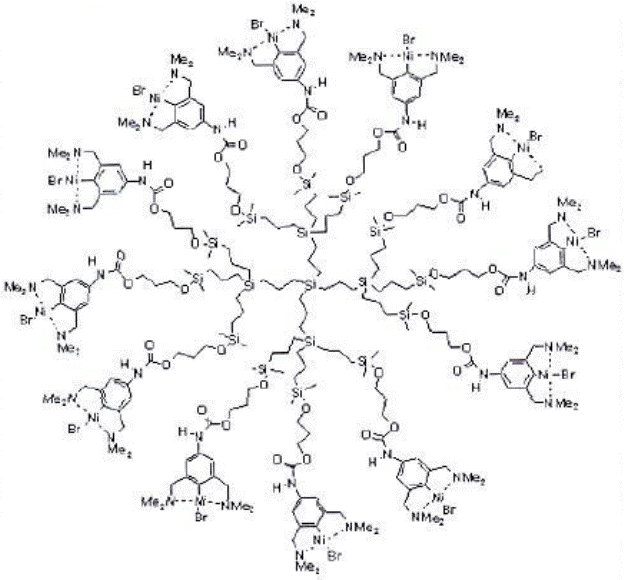
Вариантом подобных систем являются катализаторы нового
поколения – дендримеры. Это системы, синтезируемые путем специфического гидролиза кремний – этилатов. На терминальных атомах Si таких дендримеров можно закрепить комплексы Ni и других металлов 8-й группы. Тогда возникает гигантская шарообразная молекула (глобула) с поверхностью, покрытой комплексами металлов.
Диаметр такого дендримера составляет 8,5 нм и он может быть легко отделен ультрафильтрацией.
и) использование в качестве катализаторов нанодисперсных форм катализатора.
Следует выделить два аспекта качественного изменения активности гетерогенных катализаторов, в которых активный компонент находится в нанодисперсном состоянии.
1. Практическая доступность всех реакционных центров.
2. Повышение активности активных центров.
Последнее связано с увеличением на поверхности частиц катализатора ребер, углов и других неровностей, обусловливающих их координационную ненасыщенность.
В качестве апробированных вариантов нанодисперсных катализаторов можно привести два типа нанодисперсных оксидов.
1. Использование в качестве катализаторов хлорирования метана нанодисперсного оксида магния.
При реализации этого процесса имеет место система последовательных реакций
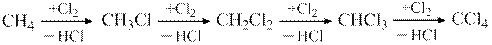
Практический интерес представляют хлорметан, дихлорметан и трихлорметан. Образование CCl4 нежелательно, так как согласно Монреальскому протоколу он отнесен к сильным озоноразрушителям. Действующий процесс осуществляется в газовой фазе при температуре 5000С. Использование MgO позволяет снизить температуру на 2000С и одновременно увеличить селективность. Так, при 50%-ной степени конверсии метана удается повысить выход полезных продуктов от 60 до 95%.
2. Каталитическое дегидрохлорирование 1,2-дихлорэтана на нанодисперсном оксиде алюминия
CH2ClCH2Cl ® CH2=CHCl + HCl
обеспечивает более высокую стабильность по сравнению с известными катализаторами и в большинстве случаев превосходит их активность.
к) переход на технику кипящего слоя в гетерогеннокаталитических реакциях.
Реакционный узел кипящего слоя изображен ниже.
| Благодаря эффективному гидродинамическому режиму обеспечивается эффективный съем тепла реакции. К катализаторам предъявляется требование высокой механической прочности. Сам катализатор изготавливается из прочного материала, а его частицы представляют собой микросферы. Благодаря этому удается минимизировать потери катализатора за счет истирания. |
Процесс успешно реализован в процессах МТО и MTG
| CH3OH ® олефины ® парафины + ароматические соединения | |||
| SAPO-34 | ZSM–5 |
а также в окислительном аммонолизе пропена
| CH3–CH=CH2 + 3/2O2 + NH3 ® CH2=CH–CN + Q + 3H2O |
л) проведение процессов во взмученном слое катализатора.
Примером подобного процесса является гидрирование эфиров высших карбоновых кислот в спирты С10–С18
CnH2n+1COOCH3 + H2 ® Cn+1H2n+3OH + CH3OH
В металлургическом производстве сера выбрасывается в окружающую среду в виде таких токсичных соединений, как SO2, COS и H2S. Эти соединения образуются в результате выгорании серы из железосодержащей шихты, угля, топлива, а также жидкого металла и шлака. Газообразные соединения серы в дымовых газах металлургического производства являются продуктами комплекса, как минимум 17 химических реакций. К главным из них можно отнести следующие реакции:
С + 0,5 О2 + S = COS;
COS + O2 = СО + SO2;
S + O2 = SО2;
H2 + 0,55S = SО2;
СаО + SO2 + 0,5O2 = СаSО4
Вероятность протекания тех или иных реакций в данных условиях можно определить путём анализа термодинамических характеристик процесса. Комплексное исследование термодинамической возможности протекания химических реакций в металлургической системе С + О2 + Fe2O3 + S + СаО + Н2
выполненное по программе ИВАНТЕРМО, показало, что качественный и количественный состав соединений серы в выбросах металлургического производства зависит от химического состава шихтовых материалов, температуры процесса и окислительного потенциала газовой фазы. В таблице 6.2 приведены соединения серы, которые могут образовываться в заданных условиях.
α - коэффициент расхода воздуха;
αА - действительный расход воздуха, подаваемого на горение;
αТ - теоретический расход воздуха на полное горение воздуха.
При выходе из дымовой трубы в дневное время под действием солнечного света сернистый ангидрид (SO2) окисляется в серный газ (SO3), соединяясь с водяными парами даёт кислоты (Н2SO3, Н2SO4), которые оказывают ещё более вредное воздействие на здоровье людей, разрушает стальные конструкции, строительные материалы, снижает прозрачность атмосферы, способствует гибели хвойных лесов, плодовых деревьев, снижает урожайность сельскохозяйственных культур.
Переход сернистого ангидрида (SO2) в серный (SO3) ускоряется наличием в дымовых газах оксидов азота:
2NO + SO2 = N2О + SO3
NО2 + SO2 = NО + SO3
Рассчитывать выход соединений серы в дымовых газах можно только для окисли тельной области высоких температур, когда образуется только диоксид серы SO2 (сернистый ангидрид) по реакции:
S + O2 = SО2;
МSO = 2 S МТ, где
МТ – масса шихты;
S – массовая доля в ней серы.
Примеры расчёта
При сжигании 1 т мазута, содержащего 4 % серы, образуется сернистый ангидрид в количестве
МSO2 = 1* 0,04*64*(64:32) = 0,08 т, где
МSO2 = 64- молекулярная масса SO2;
МS = 32 - молекулярная масса серы,
Таким образом, сернистого ангидрида образуется в два раза больше по сравнению с исходным содержанием серы в сырье.
При сжигании твердого топлива количество сернистого ангидрида определяется по формуле, кг/час:
МSO2 = 0,01*В*SР*(1 - ηSO2) МSO2/ МS, где
SР – содержание серы в топливе на рабочу. массу, %;
В - расход топлива, кг/час;
ηSO2 – доля оксидов серы, связанных летучей золой.
Доля оксидов серы, связанных летучей золой, при сжигании различных видов топлива установлена экспериментально и составляет:
Сланцы 0,5
Угли Канско-Ачинского бассейна 0,2
Торф 0,15
Экибастузский уголь 0,1
Остальные угли 0,1
Мазут 0,02
Газ 0,0
При расчёте SO2 в агломерационном производстве следует учитывать степень десульфурации руд (КД) в зависимости от их минерального состава: для сульфидных руд она составляет 0,9-0,95 %, а для сульфитных – 0,4-0,7 %.
Количество сернистого ангидрида, содержащегося в удаляемых от агломерационных машин газе, рассчитывается по формуле, т/год:
МSO2 = Σ GМ*SМ*КД* МSO2/ММ, где
GМ - масса составляющих шихты, т/год;
SМ – серосодержащие составляющие шихты, %;
КД - степень десульфурации составляющих шихты;
МSO - молекулярная масса SO2;
ММ - молекулярная масса составляющих шихты.
пример расчёта выбросов сернистого ангидрида от зоны спекания агломерационных лент представлен в таблице 5.2.
Сводные данные по количеству SO2, выделяющегося от металлургических производств представлены ниже на примере завода производительностью 6 млн.т стали в год. на заводе спекаются руды с серосодержанием, указанным в таблице 6.2.. на ТЭЦ сжигается продукт с серосодержанием 1,18 %, а также доменный и коксовый газ.
Производство т/год %
коксохимическое 3 000 1,0
агломерационное 180 000 61,0
доменное 1 000 0,3
сталеплавильное 50 0,02
прокатное 600 0,2
огнеупорное и известковое 1 200 0,4
ремонтное хозяйство 50 0,3
шлакопереработка 1 000 0,3
ТЭЦ 110 000 37,0
Всего 296 900 100,0
Таким образом, на металлургических заводах в основном два главных источника загрязнения воздуха сернистым ангидридом: аглофабрика и ТЭЦ.
Способы очистки выбросов от оксидов серы
Сократить выброс оксидов серы можно первичными и вторичными методами.
Первичные методы – подавление образования оксидов серы.
Вторичные методы – улавливание оксидов серы из дымовых газов.
Для уменьшения концентрации сернистого ангидрида в воздухе городов реальными из первичных методов считаются:
- замена твёрдого топлива и высокосернистого мазута природным газом и малосернистым мазутом, хотя бы в отдельных котельных и ТЭЦ, находящихся в непосредственной близости от жилых массивов;
очистка мазута от серы на нефтеперегонных заводах;
- кратковременное сжигание малосернистого мазута или газа на электростанциях при особо неблагоприятных метеорологических условиях;
- разработаны процессы десульфирования угля путём дробления, промывки водой, измельчения, удаления серного колчедана из угля с помощью воздушных сепараторов;
- есть разработки по десульфированию жидкого и газообразного топлива.
В США принято решение не применять топливо с SР > 1 % на электростанциях крупных городов (Нью-Иорк, Вашингтон и др). Во Франции повсеместно используется мазут с SР < 1 %. В ФРГ по закону SO2 в отходящих газах должно быть менее 2,5 г/м3 (любым способом очистки).
Очистка газов от SO2
Три способа очистки:
абсорбционный – сорбентом является жидкость;
адсорбционный – сорбентом является твёрдое тело;
каталитические методы с получением S и серной кислоты.
Абсорбционные способы – это наиболее распространённые способы очистки газов от SO2. Отличаются составом используемого сорбента, конструкциями аппаратов и полученными побочными продуктами. В большинстве случаев, как поглотительный раствор используется известь, которая взаимодействует с SO2 по реакции:
Са(ОН)2 + SO2 + 0,5О2 = Са SO4 + Н2О
Способ реализуется в полом форсуночном скруббере с гладкими гуммированными стенками при отсутствии отстойных зон, способствующих образованию отложений гипса. Процесс проводится в одну или две ступени. В одноступенчатом аппарате в зону очистки одновременно с поглотительным раствором вдувают воздух, кислород которого окисляет сульфит кальция до сульфата, что приводит к повышению растворимости извести и выпадению в осадок кристаллов гипса. При очистки в одну ступень степень очистки составляет 60-70 %. В двухступенчатом аппарате степень очистки составляет 95 %.
Повышают эффективность процесса очистки абсорбционным методом от SO2:
- турбулизацией газового потока;
- проведением процесса в присутствии марганцевого или железного катализатора;
- добавлением в поглотительный раствор: сахарозы 2-5 %
сахара 8,6 %
муравьиной и карбоновой кислот
хлорида кальция 20-30 %
Способ очистки широко распространён за рубежом. Побочным продуктом обезвоживания осадка в гидроциклонах и ленточных вакуум-фильтрах является гипс. Гипс в Японии используется в строительстве и в качестве удобрений. В США идёт в шлам.
Помимо известковых растворов, в качестве абсорбента SO2 используется побочный продукт коксования – аммиачная вода. В этом случае получают товарный продукт сульфат аммония, который используется качестве удобрения. Эффективность процесса невелика, разработано техническое решение – интенсификации процесса взаимодействия оксидов серы с аммиаком ионизацией SO2 направленным пучком электронов.
Используют и мокрые газоочистные аппараты, при этом оксиды серы растворяются в чистой воде, однако величина растворимости невелика. Эффективность улавливания SO2 в мокрых газоочистных аппаратах не превышает 30-40 %.
Недостатком мокрых способов очистки газов от оксидов серы являются:
- наличие шламового хозяйства;
- зарастание аппаратов отложениями гипса.
Для борьбы с отложениями увеличивают расход поглотителя, применяют скруббера с минимальной рабочей поверхностью.
Адсорбционный способ очистки газов от оксидов серы осуществляется путём вдувания порошкообразного сорбента в очищаемые дымовые газы или путём фильтрации последних через слой дроблённой извести. Эффективность вдувания сорбента не превышает 40 %. При фильтрационном способе очистки можно достичь эффективности 98 %.
Наиболее перспективным способом очистки газов от оксидов серы является мокросухой способ. Улавливание идёт суспензией. Активный реагент – кальцинированная сода и известь. Улавливание кристаллов гипса осуществляется в тканевых и электрофильтрах. Эффективность мокросухого способа улавливания SO2 составляет 90 %.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 855; Нарушение авторских прав?; Мы поможем в написании вашей работы!