
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ В. 1. Рассчитать рН раствора, полученного смешением 25 см3 0,1М раствора HCl, 20 см3 0,2М раствора NaOH и 50 см3 воды. Дано: = 20см3 = 0,2 мол
|
|
|
|
1. Рассчитать рН раствора, полученного смешением 25 см3 0,1М раствора HCl, 20 см3 0,2М раствора NaOH и 50 см3 воды.
Дано:
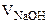 = 20см3 = 20см3
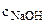 = 0,2 моль/л = 0,2 моль/л
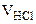 = 25см3 = 25см3
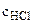 = 0,1 моль/л = 0,1 моль/л
|
| рН -? |
РЕШЕНИЕ:
NaOH + HCl → NaCl + H2O (7.5)
Рассчитываем химическое количество исходных веществ:
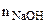 =
= 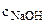 ·
·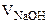 = 0,2 ·20·10-3 = 4·10-3 = 0,004 моль,
= 0,2 ·20·10-3 = 4·10-3 = 0,004 моль,
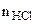 =
=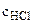 ·
·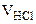 = 0,1·25·10-3 = 2,5·10-3 = 0,0025 моль
= 0,1·25·10-3 = 2,5·10-3 = 0,0025 моль
10-3 – коэффициент перевода мл в л.
Из уравнения реакции (7.5) следует, что число моль NaOH, вступившего в реакцию, равно числу моль HCl.
Определяем вещество, оставшееся в избытке:
0,004 моль > 0,0025 моль.
Следовательно, в избытке, который определяет рН среды остался NaOH.
Тогда количество избыточного NaOH в растворе:
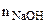 = 0,004 - 0,0025 = 0,0015 моль.
= 0,004 - 0,0025 = 0,0015 моль.
Учитывая, что суммарный объем раствора складывается из объемов двух растворов и воды,
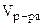 =
=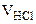 +
+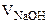 +
+ 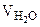 = 25·10-3 + 20·10-3 + 50·10-3 = 95·10-3л,
= 25·10-3 + 20·10-3 + 50·10-3 = 95·10-3л,
Молярная концентрация NaOH равна:
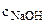 =
= 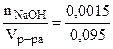 = 0,016 моль/л.
= 0,016 моль/л.
Так как диссоциация NaOH протекает по уравнению:
NaOH = Na+ + OH-, то
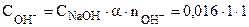 = 0,016 моль/л.
= 0,016 моль/л.
рОН = - lg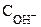 = - lg 0,016 = 1,80.
= - lg 0,016 = 1,80.
рН = 14 – рОН,
рН = 14-1,80 = 12,20.
Ответ: рН = 12,20.
2. Определить, образуется ли осадок, если смешали 100 см 0,01М водного раствора хлорида кальция и 200 см
0,01М водного раствора хлорида кальция и 200 см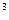 0,02М водного раствора карбоната натрия.
0,02М водного раствора карбоната натрия.
Дано:
с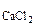 = 0,01M
с = 0,01M
с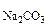 = 0,02M
V = 0,02M
V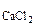 = 100 cм = 100 cм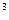 V
V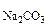 = 200 cм = 200 cм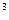
|
| Образуется ли осадок? |
РЕШЕНИЕ:
При смешении растворов протекает следующая реакция:
СaCl2+Na2CO3= CaCO3↓+ NaCl (7.6)
Осадок CaCO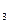 образуется только в случае, если
образуется только в случае, если
с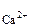 ·с
·с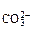 >ПР
>ПР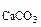 =5·10
=5·10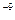 (табл.)
(табл.)
Поскольку смешали 100 cм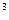 раствора CaCl
раствора CaCl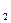
 и 200 cм
и 200 cм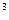 Na
Na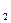 CO
CO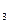 , то объем раствора после смешения составляет 300 cм
, то объем раствора после смешения составляет 300 cм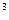 . После смешения с учетом разбавления растворов концентрации ионов Ca2+ и CO
. После смешения с учетом разбавления растворов концентрации ионов Ca2+ и CO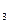 2- будут равны:
2- будут равны:
с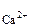 =
= 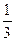 с
с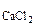 ·
·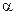 ·n
·n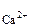 ; с
; с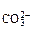 =
= 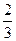 с
с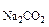 ·
·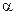 ·n
·n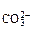
CaCl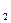 и Na
и Na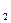 CO
CO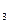 - сильные электролиты,
- сильные электролиты, 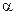 = 1.
= 1.
Процессы диссоциации CaCl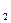 и Na
и Na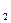 CO
CO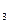 протекают по следующим уравнениям:
протекают по следующим уравнениям:
CaCl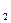 = Ca
= Ca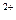 +2Cl
+2Cl
Na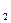 CO
CO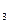 = 2Na
= 2Na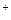 +CO
+CO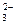
следовательно, n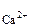 = 1 и n
= 1 и n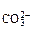 = 1.
= 1.
с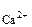 =
= 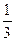 0,01·1·1 = 3,3·10
0,01·1·1 = 3,3·10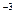 моль/л,
моль/л,
с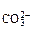 =
= 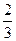 0,02·1·1 = 1,3·10
0,02·1·1 = 1,3·10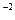 моль/л.
моль/л.
с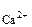 ·с
·с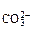 = 3,3·10
= 3,3·10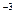 ·1,3·10
·1,3·10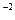 = 4,29·10
= 4,29·10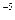
Так как 4,29·10-5 > 5·10-9 (ПР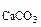 ), то осадок CaCO
), то осадок CaCO образуется.
образуется.
Ответ: осадок CaCO образуется.
образуется.
3.Вычислить рН 0,0IM водного раствора HNO2, содержащего, кроме того, 0,02 моль/л KNO2.
Дано:
с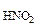 = 0,01 M
с = 0,01 M
с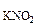 = 0,02 M = 0,02 M
|
| рН -? |
РЕШЕНИЕ:
рН = - lg с
HNO2 <=> H+ + NO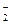 (7.7)
(7.7)
KNO2 = K+ + NO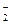 (7.8)
(7.8)
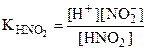
Прибавление KNO2 к раствору HNO2 смещает равновесие диссоциации HNO2 влево за счет увеличения концентрации иона NO2-. В результате, в системе устанавливается равновесие при новых концентрациях Н+ и NO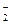 , но значение константы диссоциации HNO2 при этом остается прежним.
, но значение константы диссоциации HNO2 при этом остается прежним.
Тогда обозначим равновесную концентрацию ионов [Н+] в новых условиях через х:
[H+] = х моль/л.
Общая равновесная концентрация иона [NO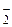 ] равна сумме концентраций иона NO
] равна сумме концентраций иона NO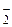 , образовавшегося при диссоциации HNO2 и при диссоциации KNO2:
, образовавшегося при диссоциации HNO2 и при диссоциации KNO2:
[NO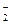 ] = с
] = с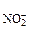 + с
+ с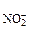 .
.
из HNO2 из KNO2
Концентрация ионов NO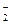 , образовавшихся при диссоциации HNO2, равна х моль/л, так как при диссоциации 1 моль HNO2 образуется 1 ион Н+ и 1 ион NO
, образовавшихся при диссоциации HNO2, равна х моль/л, так как при диссоциации 1 моль HNO2 образуется 1 ион Н+ и 1 ион NO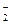 (из уравнения 7.7).
(из уравнения 7.7).
Концентрация ионов NO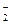 , образовавшихся при диссоциации КNO2 равна: с
, образовавшихся при диссоциации КNO2 равна: с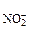 = с
= с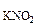 ·α·n
·α·n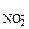 = 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
= 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
КNO2 - сильный электролит, α = 1, n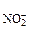 = 1.
= 1.
тогда [NO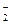 ] = (х + 0,02) моль/л
] = (х + 0,02) моль/л
Равновесная концентрация недиссоциированных молекул
[HNO2] = (0,01 – х) моль/л.
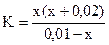 = 4·10-4, (табл.)
= 4·10-4, (табл.)
так как, х << 0,01 моль/л, то значением х, ввиду его малого значения, в выражениях (х+0,02) и (0,01- х) можно пренебречь, и данное выражение записать в виде:
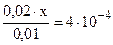 ; откуда х = [H+] = 2 · 10-4 моль/л
; откуда х = [H+] = 2 · 10-4 моль/л
рН = -lg(2·10-4) = 3,7
Ответ: рН = 3,7
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1529; Нарушение авторских прав?; Мы поможем в написании вашей работы!