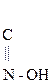КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксокислоты
|
|
|
|
Это карбоновые к-ты, содержащие карбонильную группу. Различают кето- и альдегидок-ты.
Номенклатура
Тривиальная, рациональная, международная:
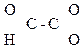 СН3–
СН3– 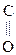 –СООН СН3–
–СООН СН3– 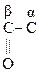 Н2–СООН
Н2–СООН
Глиоксалевая Пировиноградная Ацетоуксусная к-та (АУК),
к-та к-та (ПВК), b-кетомасляная к-та,
a-кетопропионовая, 3-оксобутановая к-та
2-оксопропановая
к-та
Изомерия кеток-т – это изомерия цепи и положения гр. 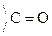 .
.
Оксок-ты могут быть одно-, двух- и многоосновные.
НООС–(СН2)2–  –СООН, НООС–СН2–
–СООН, НООС–СН2–  –СООН
–СООН
a-Кетоглутаровая к-та Щавелевоуксусная к-та (ЩУК),
2-кетоянтарная к-та
Все указанные к-ты являются естественными продуктами обмена веществ.
Оксок-ты, имея в молекуле гр. –СООН и 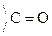 , обладают св-вами, характерными для к-т, альдегидов и кетонов.
, обладают св-вами, характерными для к-т, альдегидов и кетонов.
Р-ции по гр. –СООН – смотрите р-ции в разделе оксик-т; оксок-ты диссоциируют, образуют соли, сложные эфиры, ангидриды, хлорангидриды, амиды.
По карбонильной гр. идут р-ции АN, при этом образуются оксимы, гидразоны, оксинитрилы и т.д., т.е. проходят р-ции с Н2, РС15, NH2OH, NH2– NH2, NH2–NH–С6Н5, НСN, НОR, р-ции окисления.
|
|
|
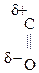 –СООН
–СООН 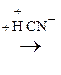
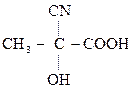 ,
,
|
|
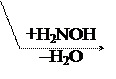
В этом случае р-ции протекают легче, чем для обычных кетонов.
2-оксо-ты окисляются даже такими слабыми окислителями как Сu(ОН)2, при этом образуются две к-ты как и для типичных кетонов:
Н2О + СО2
|
|
 –СООН + О + НОН ® СН3СООН + НО–СООН
–СООН + О + НОН ® СН3СООН + НО–СООН
Пировиноградная к-та
Это результат увеличения d+ заряда атома С гр. 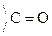 и объясняет также способность кеток-т легко декарбоксилироваться. Пировиноградная к-та при нагревании или действии фермента декарбоксилазы разлагается:
и объясняет также способность кеток-т легко декарбоксилироваться. Пировиноградная к-та при нагревании или действии фермента декарбоксилазы разлагается:
|
 –СООН ® СН3–
–СООН ® СН3– 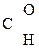 + СО2
+ СО2
Ацетоуксусная к-та легко декарбоксилируется как и все b-кеток-ты даже при слабом нагревании:
СН3–  –СН2–СООН
–СН2–СООН 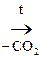 СН3–
СН3–  –СН3
–СН3
АУК Ацетон
В свою очередь 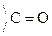 группа, оказывая влияние на гр. –СООН, увеличивает ее кислотность. ПВК в 500 раз сильнее пропионовой к-ты.
группа, оказывая влияние на гр. –СООН, увеличивает ее кислотность. ПВК в 500 раз сильнее пропионовой к-ты.
Для оксок-т характерно существование двух изомерных форм: кетонной и енольной, легко переходящих друг в друга и находящихся в динамическом равновесии. Напомним, что явление существования вещ-ва в виде нескольких изомерных формах, легко переходящих друг в друга и находящихся в подвижном равновесии, наз-ся таутомерией. В зависимости от возникающих групп таутомерия наз-ся по-разному: кето-енольная, лактим-лактаимная, прототропная. Для кеток-т характерна кето-енольная таутомерия:
|
|
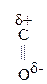
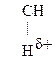 –
– 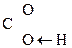 Û R–
Û R– 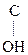 =CH–
=CH– 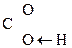 .
.
Кето-енольная таутомерия встречается и в обычных альдегидах и кетонах, однако енола содержится в таких системах очень мало (~ 2,5 ×10-5%), т.е. равновесие практически сдвинуто в сторону кетонной формы:
СН3–  –СН3 СН3–
–СН3 СН3– 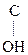 =CH2
=CH2
Ацетон
Введение ЭА заместителя у енолизированного атома С, например гр. –СООН, смещает равновесие в сторону енола:
|
|
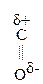 –
– 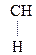 –
– 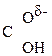 Û СН3–
Û СН3– 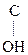 =CH–СООН
=CH–СООН
Енольная форма стабилизируется, если двойная С=С связь сопряжена со второй p-системой или гр. –ОН участвует в образовании внутримолекулярной Н-связи. Так, этиловый эфир ацетоуксусной к-ты существует уже на 7,5% в енольной форме, т.к. стабилизирован Н-связью:
СН3– 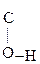 СН–
СН–  –ОС2Н5 Û СН3–
–ОС2Н5 Û СН3–  –CH2–
–CH2– 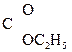 .
.
Смещение равновесия зависит от природы растворителя, температуры (с ее увеличением уменьшается содержание енольной формы) и др. факторов.
Доказательством наличия енольной формы являются р-ции: с Вr2 (водой) – на двойную связь (обесцвечивание), с FeC13 р-ция на –ОН гр. (фиолетовое окрашивание); наличие 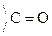 гр. – р-ции с NH2OH, NH2– NH2, NH2–NH–С6Н5 (образование осадков).
гр. – р-ции с NH2OH, NH2– NH2, NH2–NH–С6Н5 (образование осадков).
Многие р-ции в живых организмах проходят через енольную форму. Так, фосфорный эфир пировиноградной к-ты является важным фосфолирующим и ацилирующим агентом обмена вещ-в:
CH2= 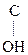 –
– 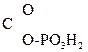 .
.
Вопросы для самоконтроля:
1. Что такое оксикислоты?
2. Химические свойства оксикислот.
3. Оптическая изомерия оксикислот.
4. Что такое оксокислоты?
5. Химические свойства оксокислот.
6. Кето – енольная таутомерия оксокислот.
7. Что такое фенолокислоты?
8. Химические свойства фенолокислот.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 604; Нарушение авторских прав?; Мы поможем в написании вашей работы!